- 精選文章
文章專區
2021-05-01捕捉蛋白質動態結構的神兵利器:雙電子共振技術
617 期
Author 作者
李介勤/清華大學化學系博士,致力於細胞膜蛋白動態構形研究。江昀緯/清華大學化學系教授,專精於電子自旋共振技術開發與應用。
蛋白質掌控了生物的生理作用,而蛋白質的功能又與其結構密切相關,藥物開發便是以蛋白質結構為基礎設計藥物分子,進而調控蛋白質功能、影響生理。多數蛋白質結構並非單一固定,會以多重構形共存,在執行功能時相互轉換,也稱為蛋白質的多重動態構形。蛋白質的動態構形不易研究,而電子自旋共振(electron spin resonance, ESR)是少數能捕捉蛋白動態構形的光譜工具,亦是重要的化學生物技術。
結構生物學的當前課題
繼人工智慧AlphaGo在圍棋領域上打敗人類最強棋手後,DeepMind又推出AlphaFold試圖藉著人工智慧的手,解開蛋白質折疊之謎。去(2020)年12月,AlphaFold 2以超過九成的準確度,精準預測了多個蛋白質的折疊結構,此突破有望縮短藥物開發的進程。然而,蛋白質的構形並非單一固定,而是在多個相關構形中不停相互轉換,以調節其功能;換句話說,解出單一結構只是研究蛋白質功能的第一步,如何解析蛋白多重結構、捕捉動態構形,才是藥物開發研究下一步的重要課題。
面對動態複雜的蛋白質系統,多樣化的ESR技術,將能有效揭露蛋白質調節生理功能的機轉(mechanism),有助於設計藥物分子來達到控制生理反應、抑制細菌、病毒等過程。
不安分的蛋白質—蛋白質動態構形
蛋白質是由胺基酸(amino acid)組成的生物巨分子,藉由20種胺基酸的排列,堆疊出不同結構。複雜多變的結構決定了蛋白質多樣化的功能,而蛋白質及其周遭分子,包含溶劑、其他生物分子等的交互作用,使得蛋白質能在多種結構間相互轉換,稱為蛋白質的動態構形(圖一a)。藥物開發便是基於對蛋白質結構的了解,設計出能與目標蛋白質結構結合的小分子,進一步調控蛋白質功能。
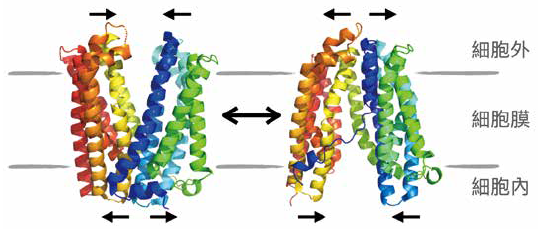
(a)蛋白質構形的動態平衡。圖中以膜蛋白質MATE為例,MATE會在面朝外以及面朝內的開合方式間形成動態構形。
圖一b為蛋白質動態結構與藥物分子之間關係的簡單概念。圖例中的蛋白質具有A、B兩種動態構形,構形B能和其他蛋白質結合,誘發下游的致病機轉。為了避免疾病發生,我們可以根據構形A、B分別設計出藥物a、b。根據勒沙特列原理(Le Chatelier principle),若加入藥物a使它與構形A結合,將會破壞原本構形A、B之間的動態平衡,並減少構形B的產生,抑制下游致病機轉。
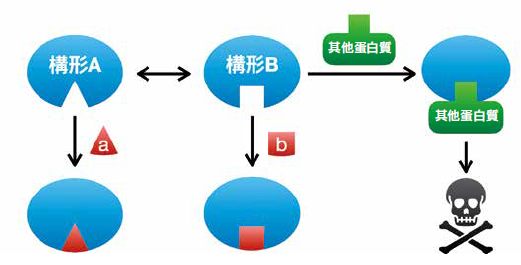 (b)蛋白質動態結構與藥物分子的概念圖例。若開發出的藥物a、b能與致病蛋白質的構型A、B結合,便有可能抑制疾病的致病機轉。
(b)蛋白質動態結構與藥物分子的概念圖例。若開發出的藥物a、b能與致病蛋白質的構型A、B結合,便有可能抑制疾病的致病機轉。
而另一種方式則是以藥物b和致病蛋白競爭,同樣也可以抑制致病機轉,至於藥物a、b的選擇與設計,則取決於蛋白質A、B哪一種構形容易鑑定出來。當然這只是一個簡單的比喻,實驗中常見的實際情形卻是蛋白質常以多重構形存在,科學家難以一窺全貌,使設計有效藥物這件事變得極度困難。……【更多內容請閱讀科學月刊第617期】