- 科技報導
- 生醫先鋒
文章專區
2023-09-15全球首款RSV母嬰疫苗有望核准使用?RSV疫苗的最新研究進展
501 期
Author 作者
周彥宏/國家衛生研究院感染症與疫苗研究所研究員、中國醫藥大學生物醫學研究所合聘教授。
呼吸道融合病毒(respiratory syncytial virus, RSV)為負股RNA病毒,屬於副黏液病毒科(Paramyxoviridae)。病毒具有外套膜(envelope),表面有兩個主要的醣蛋白——F蛋白質(fusion protein)與G蛋白質(attachment glycoprotein G),並可根據G蛋白質抗原特性分為A、B兩群。RSV易感染六個月以下嬰幼兒、心臟病者、肺功能異常者、免疫不全者及老年人,感染者會產生嚴重的上呼吸道以及下呼吸道症狀,包括鼻炎、支氣管炎及肺炎,某些產生嚴重下呼吸道症狀的感染者可能因此引發過敏、氣喘。感染RSV的病症進展有可能非常快速,從發燒到呼吸窘迫(respiratory distress)僅需兩、三天。
一歲以下嬰幼兒為RSV的高感染族群,而在2~4歲時可能產生第二次的感染。根據美國美國疾病管制與預防中心(Centers for Disease Control and Prevention, CDC)統計,因為呼吸道症狀而住院的病童約有32%被診斷出遭RSV感染;而每年約有8萬5000~14萬4000名兒童被RSV感染需要住院治療,其中包括20~25%診斷為肺炎,70%為支氣管炎。在臺灣,每一年約有1000名嬰幼兒因感染RSV而入院,其中一成為早產兒,大多為兩歲以下嬰幼兒。綜觀全球,此病毒一年至少奪走了16萬名嬰幼兒的性命。在用藥方面,對於高危險的族群,可給予對抗F蛋白質的單株抗體Palivizumab預防性給藥,但此抗體屬於非治療性給藥,且需要每月給一次,療程耗費高且對於心臟病者並不適用。因此有效且安全的RSV疫苗對於守護嬰幼兒與孩童的健康非常重要,本文將由RSV疫苗發展的過程談起,並進一步介紹國家衛生研究院(簡稱國衛院)疫苗中心的研發進展。
RSV疫苗的發展過程及種類
1960年,科學家嘗試研發第一支針對RSV的疫苗,利用福馬林(formalin)將病毒去活性後經肌肉注射給予孩童。然而,此疫苗沒有產生有效的保護力,注射疫苗後再被感染RSV,仍有80%的受試者產生嚴重的肺炎症狀,甚至有兩位受試孩童在試驗期死亡。
近年來針對RSV研發的疫苗綜觀分為以下幾類:
1.次單元疫苗(subunit vaccine):以蛋白質為抗原混合佐劑的疫苗,抗原包括RSV F蛋白質、RSV G蛋白質、M蛋白質或RSV的胜肽。此類疫苗的優點為疫苗本身具有安全性,然而依據佐劑的不同,產生的炎症反應也不同。研發的重點放在引起第一型輔助性T細胞(Type 1 T helper cell, Th1 cell)免疫反應,例如使用CpG ODN、MPL、QS21、ASO1、ASO2等佐劑;以及引起體液型(humoral)的免疫反應,例如使用ISCOMS、Liposome等佐劑。此外,還有一款以哺乳細胞表達F蛋白質的次單元疫苗,正在進行安全性臨床試驗以及免疫初期試驗。
2. DNA疫苗(DNA vaccine):以不具複製能力的載體如質體(plasmid)或病毒載體表達RSV抗原,此類疫苗由表達F蛋白質或G蛋白質的質體組成,合併表達細胞激素(cytokine)IL-2、IL-12、IFN-γ等。此類疫苗在動物實驗顯示,可引起抗體反應以及細胞性免疫反應,同時並未發現炎症病理現象,因此從安全性考量來看有成為疫苗的潛力。
3. 病毒載體疫苗:以具複製能力的病毒載體表達RSV抗原,包括以人類副流感病毒(Parainfluenza virus type 3, PIV3)、牛痘病毒(Vaccinia virus)、腺病毒(Adenovirus)為載體等。以PIV3為載體的RSV疫苗,2004年於非洲綠猴的臨床前期試驗後已進入第一期人體試驗,2012年已證實對於6~24個月的嬰幼兒可引起抗體反應,並且未發現有肺部炎症反應。
4. 減毒疫苗:包括重組RSV、牛呼吸道融合性病毒(bovine respiratory syncytial virus, BRSV)等。此類疫苗最大的好處為引起較強的黏膜型(呼吸道即為黏膜組織)免疫反應。疫苗選用較穩定以及安全性較高的突變株RSV-cp(cold passage)、RSV-ts (temperature sensitive)。在較年長的兒童及一到二歲的嬰幼兒的第一期臨床試驗中顯示,兒童身上的確產生了抗體反應(即使抗體反應只侷限為IgA並且不具有中和效價),而且未發現炎症現象;然而對於嬰幼兒卻發生上呼吸道輕微的發炎現象,因此減毒疫苗的安全性以及保護力仍待評估。
最近,國際醫藥大廠如輝瑞(pfizer)、葛蘭素史克(GlaxoSmithKline, GSK)、莫德納(Moderna)、阿斯特捷利康(AstraZeneca, AZ)、賽諾菲(Sanofi)、楊森製藥(Janssen)針對RSV疫苗研發並進入第三期臨床試驗。日前已有部分的疫苗安全性通過認可核准上市,首先是GSK的次單元疫苗Arexvy,為RSV A型重組蛋白質混合佐劑,於今(2023)年6月經歐洲藥品管理局(European Medicines Agency, EMA)接著7月美國食品藥物管理局(U.S. Food and Drug Administration, FDA)審查通過,此疫苗可用於60歲以上長者接種。而輝瑞研發的次單元疫苗Avrysvo(RSVpreF)則使用RSV A型加B型重組蛋白質,已獲得FDA專家推薦,預計有機會於今年獲得核准。此疫苗由懷孕女接種,可在生產後保護六個月以下的新生幼兒。另外,AZ與賽諾菲研發的Beyfortus為針對RSV F蛋白具有特異性單株抗體,於去(2022)年12月經EMA核准,接著在今年1月美國FDA審查通過,用於懷孕婦女接種,保護六個月以下新生幼兒。其他如楊森製藥的腺病毒載體疫苗Ad26.RSV.preF、莫德納的mRNA疫苗mRNA-1345表達穩定preF蛋白質等,目前也正在進行第三期臨床試驗(表一)。
RSV疫苗研發的重點與難處
RSV疫苗的研發有幾個重點。首先,在1960年以福馬林去活性的病毒為疫苗得到的經驗發現,RSV疫苗研發製作除了有效清除病毒活性,還必須避免引起肺部的炎症反應〔註〕。其次,近半世紀的研究發現,有效清除掉RSV感染,需要引起適當的免疫反應,包括必須引起適當的細胞型免疫反應如CD8 T細胞的毒殺作用,以及引起具有中和性效價的抗體反應。而RSV疫苗研發的進展緩慢也與幾個原因有關:
〔註〕肺部炎症反應包括過高的第二型輔助性 T 細胞(type 2 T helper cell, Th2 cell)免疫反應,伴隨著肺部的嗜伊紅性球(eosinophil)浸潤,以及細胞激素如 IL-4、IL-5 等過量產生。
1.感染RSV的個體,可能再次被感染並且產生症狀,因此證實免疫系統缺乏對於RSV的長期記憶,疫苗開發也會遇到相同的問題。
2. 主要感染RSV的族群為嬰幼兒,不僅免疫系統不成熟,無法引起有效的抗體反應,而且針對這類疫苗的安全評估,目前也缺乏適合的動物模組可用於臨床前試驗。
3. RSV經由呼吸道感染,因此研發的重點必須有效引起在呼吸道的黏膜性抗體反應。
4. 疫苗必須有效交叉對抗RSV-A型 以及RSV-B型。
5. 避免RSV疫苗引發肺部炎症反應為安全性的第一考量,因此影響了疫苗的抗原選擇。RSV外套膜的F蛋白質以及G蛋白質常被選擇為疫苗的標的物,過去以牛痘疫苗為載體表達G蛋白質或者直接給予G蛋白質做為疫苗,均引起了肺部嗜伊紅性球的浸潤。而若以同樣的載體表達F蛋白質,並不會出現肺部浸潤現象。另外,目前具有中和效價的RSV單株抗體Palivizumab即為對抗F蛋白質產生,F蛋白質也是主要引起細胞性毒殺反應的抗原,人體試驗中也證實可以引起中和性抗體產生。以上均為目前國際藥廠選擇F蛋白質為抗原的主要因素。
國衛院以腺病毒為載體的RSV疫苗
國衛院疫苗中心研發的疫苗以缺陷性第五型腺病毒(defective adenovirus type V)為載體表達F蛋白質(圖一)。此腺病毒載體缺乏腺病毒的E1基因,因此感染體內細胞並不具複製性及致病性。以腺病毒載體具有的優點為:
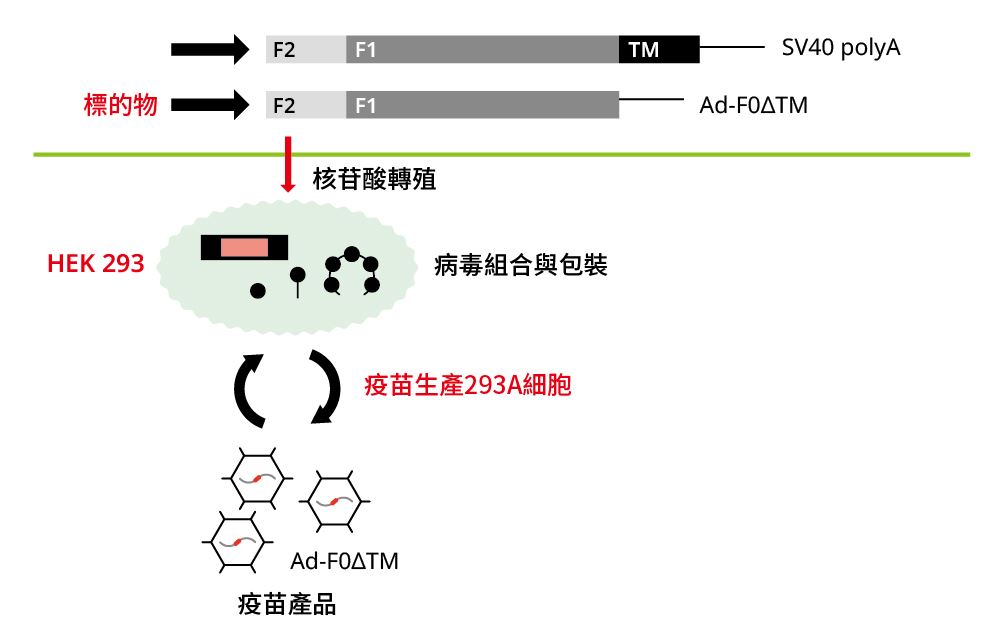
圖一|發展 Ad-RSV 疫苗的基因構築示意圖
符合cGMP規範生產腺病毒載體疫苗包括主要步驟:
1. 標的物的病毒載體基因選殖。
2. 在合格的疫苗生產細胞293細胞複製及生產。
3. 腺病毒載體疫苗純化及填充。
1. 可引起嬰幼兒較成熟的免疫反應:腺病毒可感染嬰幼兒的樹突細胞(dendritic cell),使樹突細胞成熟後呈現抗原,以此產生有效的免疫反應。
2. 透過腺病毒,可刺激身體釋放第一型干擾素(Type I interferons)細胞激素如IL-6、TNF-α、IL-12等,補償個體本身免疫反應的不足。
3. 腺病毒可經鼻腔或口服給予,不需侵入性給予(如肌肉注射),並可引起較強的黏膜性免疫反應。
4. 腺病毒可大量製備並得到高劑量的疫苗量,耗費的經濟成本相對不高。
目前以腺病毒為載體的疫苗或者基因治療方法發展快速,至少已經有200個相關技術進入臨床試驗甚至臨床使用。舉例來說,以腺病毒製成的皰疹病毒疫苗(Herpes Simplex Virus)、C型肝炎疫苗(Hepatitis C virus)、乳癌基因療法(Her-2/Neu expression)、流感病毒疫苗(Influenza virus)等均完成臨床試驗第一期的安全性試驗;而小細胞肺癌的基因療法(P53 expression)已完成第二期臨床試驗;人類免疫缺陷性病毒 (human immunodeficiency virus, HIV)以腺病毒為載體的疫苗,也已進行多項臨床試驗。新型冠狀病毒(SARS-CoV-2,簡稱新冠病毒)是導致嚴重特殊傳染性肺炎(COVID-19)的病毒,從2019年出現後對全球人類健康產生了重大影響,可能導致患者出現嚴重肺部炎症需要住院治療,甚至會導致死亡。迄今為止,新冠病毒已經造成超過6.45億人感染、超過600萬人死亡。由AZ以腺病毒載體技術研發的新冠病毒疫苗已成功在全球大規模接種,並證實此疫苗的安全性及有效降低及預防新冠病毒引起的重症的效果。另外,針對伊波拉病毒(ebola virus)的腺病毒載體疫苗也已經開發並核准用於非洲盛行地區。總結來說,目前以腺病毒為載體的疫苗,它的安全性評估均獲得了正向評價。
除安全性考量外,腺病毒載體表達RSV F蛋白質的疫苗經過一系列的有效性評估。此疫苗經過初期動物實驗證實可以有效引起中和性抗體、並且產生黏膜型的免疫反應;產生的抗體反應也可以交叉辯認RSV-A以及RSV-B。另外在細胞性免疫的部分,發現此疫苗誘導的免疫反應可增加Th1的IFN-γ釋放,而偏向Th2的細胞激素如IL-4、IL-10以及與過敏相關的細胞激素IL-13均呈現較低反應,同時此疫苗也可產生毒殺型T細胞的活化;此疫苗的有效性經由肺部病毒的測量得到直接的印證。安全性部分,給予疫苗後再被RSV感染的小鼠經肺部病理切片可證實,此疫苗並未引發肺部嗜伊紅性球浸潤現象,以及並未增加病理引起的體重減輕現象。因此無論安全性以及有效性,均證實了此疫苗的開發潛力。國衛院研發此疫苗,也在2010年得到國家生技醫療產業策進會頒發新創獎肯定。
未來展望
良好的RSV疫苗必須具有保護力,也需要避免疫苗使接種者發生類似RSV感染所引起的肺部病理現象。RSV疫苗開發最大的困難,仍然為嬰幼兒個體內免疫反應的狀況,需要更多的臨床試驗數據,以驗證疫苗的安全性以及有效性。
現階段最值得注意的疫苗為輝瑞研發的Avrysvo,是目前唯一同時針對懷孕婦女以及60歲以上族群進行臨床試驗及申請藥品上市許可的疫苗。根據輝瑞發表於《新格蘭醫學期刊》(New England Journal of Medicine)的研究資料,懷孕24~36週齡的懷孕婦女施打Avrysvo,嬰兒出生後90天內因RSV感染引起下呼吸道感染的機率下降81.8%,嬰兒出生後180天保護力仍有69.4%。因此Avrysvo獲得美國FDA核准機會很大,有機會成為全球首個獲得核准使用的母嬰RSV疫苗,為新生兒提供保護。
最後,本文中所提及已進入臨床試驗三期的疫苗也值得期待(表一)。若此疫苗最終獲得核准上市,預計可對懷孕婦女、嬰幼兒及60歲以上長者,提供更多疫苗選擇,讓人們免於RSV造成的感染與重病。
延伸閱讀
1. IMpact-RSV Study Group. (1998). Palivizumab, a humanized respiratory syncytial virus monoclonal antibody, reduces hospitalization from respiratory syncytial virus infection in high-risk infants. Pediatrics, 102(3), 531-537.
2. Shao, H. Y., et al. (2016). Immunogenicity of an adeno-vector vaccine expressing the F protein of a respiratory syncytial virus manufactured from serum-free suspension culture. Antiviral research, 130, 27-35.
3. Walsh, E. E., et al. (2023). Efficacy and safety of a bivalent RSV prefusion F vaccine in older adults. New England Journal of Medicine, 388(16), 1465-1477.