- 專訪
文章專區
2023-02-02當精準育種中的基因編輯魔法 碰上水產養殖 臺灣海洋大學水產養殖學系副教授龔紘毅專訪
638 期
Author 作者
採訪撰稿|廖羿雯本刊採訪編輯。
(本文與作物永續發展協會台灣分會合作刊出)
Take Home Message
• 基因編輯是以生物技術編輯目標基因,從而獲得理想性狀的技術。此技術可不引進外源基因,大幅縮短育種時間,得到與傳統育種、自然突變或化學誘變相似的結果。
• 龔紘毅團隊利用CRISPR-Cas9 研發出高取肉率的海大壯鯛一號,並為全球首創的粉紅色神仙魚品系中開發出完全不孕控制技術。
• 基因編輯生物或食品的爭議來自是否含有外源基因;正擬訂相關法規的臺灣可參考日本作法儘快制定適度監管的法規,才能鼓勵產業研發並與國際接軌。
從植物到動物、從可食用到觀賞性為主的品種,早在遺傳學觀念尚未完整建立前,人類就已經開始培育、篩選生物品種,並挑出想保留的性狀、排除不要的性狀,再透過繁殖代代相傳。過去的傳統育種法行之有年,藉由不同品種/品系的生物進行雜交、回交(back cross)或誘變獲得遺傳性狀變異的後代,再經過選育找出特性符合目標需求者,最終成功培育出新品種。

由徐德華助理教授(左)、龔紘毅副教授(中)、黃章文副教授(右)組成的海大水產遺傳育種團隊。(龔紘毅提供)
然而這項過程曠日費時,通常需要花費十年以上的時間才能取得好結果,即便加上分子標誌輔助選育(marker-assisted selection, MAS)也僅把育種時間縮短至5 ~ 7 年。隨著全球人口快速擴張、極端氣候發生頻仍,或是戰爭引發的嚴重糧食短缺,傳統育種法已經無法滿足現代社會需求。因此以基因體技術為核心的基因體選育(genome selection)和精準育種方法——基因編輯(gene editing)技術應運而生。
基因改造(gene modification)是透過基因轉殖(transgenesis)技術進行,經由轉殖將外源基因(意指來自非類緣種的基因)殖入細胞內,令生物表現出特定性狀或原來沒有的性狀,這些動植物被稱為基因改造生物(genetically modified organism,GMO);相比之下「基因編輯」不須引進外源基因,仍可精準編輯目標基因,從而獲得理想的性狀。近年來基因編輯帶動精準育種技術的興起,發展突飛猛進,不論在作物、水產動物、畜產動物均孕育出不少新品種。
什麼是基因編輯?
基因編輯技術意即編輯生物的基因體以控制基因表現,產出不一樣性狀的生物體。原理是以酵素精準地「切開」特定位置的DNA,使DNA 發生雙股斷裂(double-strand break, DSB),並誘發DNA 修復(DNA repair)機制。在DNA 自行修復的過程中,就有機會在連結斷裂點時產生單一或多個鹼基的缺失、修改、置換或插入。
目前基因編輯可以區分成「寡核苷酸定點突變技術」(oligonucleotide-directed mutagenesis, ODM)與「定點核酸酶技術」(site-directed nucleases,SDN)等兩大類。後者更為主流,包含三種常見系統:鋅指核酸酶(zinc-finger nucleases, ZFNs)、類轉錄活化因子核酸酶(transcription activator-like effector nucleases, TALENs)、CRISPR-Cas9。三者的主要差異在於辨認目標DNA序列的方式:ZFNs 與 TALENs 都需要合成蛋白質以辨認目標DNA 序列,流程相對複雜;CRISPR-Cas9 則透過與目標DNA序列互補的單一引導RNA(single-guiding RNA,sgRNA),就能改變Cas9 蛋白的專一性並進行剪切。
臺灣海洋大學水產養殖學系副教授龔紘毅指出,CRISPR-Cas9 比起ZFNs 與TALENs 基因編輯技術,具備精準、高效率、易操作、成本低等優點,自CRISPR-Cas9 技術在2013 年問世後,精準育種開始蓬勃發展。利用基因編輯技術分子剪刀的特性,只要鎖定目標基因片段便能促使標靶基因突變,更有效縮短選育新品種的時間至2 ~ 3 年。
龔紘毅過去曾在中研院細胞與個體生物學研究所吳金洌特聘研究員指導下進行博士與博士後研究,早年主要專攻斑馬魚(Danio rerio)的遺傳學研究,建立基因轉殖斑馬魚作為研究人類肝臟發育、肝臟基因調控及肝癌的模式系統。2008 年任教於臺灣海洋大學水產養殖系後開始研究經濟性魚種,且於2015年起將CRISPR-Cas9 系統引進實驗室,目的是運用基因編輯技術精準育種,促進養殖經濟性魚類的生長發育,以及開發魚類的不孕控制技術。
海大壯鯛一號與完全不孕神仙魚
根據現有的研究報告顯示,已經有許多經濟性水產生物在 CRISPR-Cas9 和 TALENs 的幫助下,完成標靶基因突變的精準育種,案例遍布食用魚、觀賞魚、甲殼類、軟體動物、棘皮動物、海藻等各類別。像是 2020 年,龔紘毅帶領研究團隊研發出高取肉率的吳郭魚「海大壯鯛一號」(NTOU Mighty Tilapia No.1, MT1)品系,就是臺灣少數成功的精準育種案例。
在傳統尼羅吳郭魚(Oreochromis niloticus)養殖上,由於雄魚體型發育優於雌魚,因此業界通常在小魚性別決定期間投餵添加雄性激素飼料或不同種間雜交(如尼羅雌魚與奧利亞公魚雜交),以達到單雄性養殖。龔紘毅團隊藉由 CRISPR-Cas9 精準突變尼羅吳郭魚海大 NT1 品系的肌肉生長抑制素 b(MSTNb) 基因,建立海大壯鯛一號品系。相較於原品系,新品系的背部、腹部及兩側肌肉大幅增生,體高、 體寬及體重也顯著增加,取肉率約從 30%提高到 52%。而且雌魚與雄魚成魚均明顯表現肌肉大幅增生的高取肉率性狀(圖一),現已繁殖至 F3 子代。

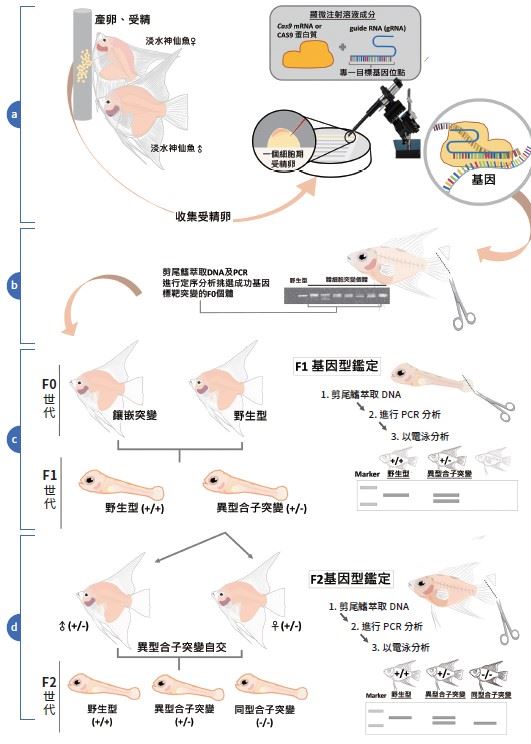
另外,龔紘毅團隊從 2009 年起也和觀賞魚出口商芝林企業有限公司合作,以顯微注射進行基因轉殖,將臺灣海域軸孔珊瑚(Acropora)的紅色螢光蛋白基因殖入淡水神仙魚一個細胞期的受精卵內,雙方合作成功在 2012 年開發出全球第一隻基因轉殖粉紅色神仙魚品系,至今已經穩定繁殖超過十代。但為了避免基因改造生物逃脫野外,與相近或相同魚種交配造成基因汙染,團隊最初試圖再用基因改造發展觀賞魚的不孕控制技術,但結果卻不如預期,只能降低神仙魚生殖能力卻無法使牠完全不孕。
後來他們轉而使用基因編輯技術,直到去(2022) 年終於突破瓶頸,透過 CRISPR-Cas9 技術精準突變 控制神仙魚原始生殖細胞(primordial germ cells, PGCs)的關鍵基因 dnd1,真正做到神仙魚的完全 不孕控制(圖二)。看似輕描淡寫的研究過程,背後隱藏著不厭其煩的觀察、學習與失敗後不斷的調整再出發。十年磨一劍,基因編輯不孕控制技術終於讓粉紅神仙魚未來有機會通過臺灣水產的 GMO 法規,進入國內水族通路及國際觀賞魚市場,為臺灣發光。

龔紘毅表示,其實現在基因編輯技術大致成熟,因此育種成功與否的關鍵反而在於水產生物完全繁養殖技術的掌握度。例如吳郭魚繁殖機制複雜,如果在雌魚卵巢成熟前放進雄魚,很可能發生雄魚攻擊雌魚致死的情形。唯有仔細觀察算準雌魚的性成熟時間,再放入雄魚成功交配,才能順利取得口孵雌魚口中剛受精的一個細胞期的受精卵以顯微注射進行基因編輯,或是建立高受精及孵化率的體外人工受精(in vitro fertilization)技術。因此,光是建立穩定取得吳郭魚一個細胞期受精卵的系統就花了快一年。有些水產生物的受精卵較脆弱或難以取得一個細胞期受精卵,究竟要用顯微注射、電穿孔法、 粒子槍、體內生殖腺電穿孔技術還是其他方法送入 gRNA-Cas9 分子剪刀?這也是一大挑戰。
龔紘毅透露,接下來他的目標是把基因編輯技術應用在更多水產物種上,包含開發更多觀賞魚,如神仙魚的不同體色及色素分布的新穎品系、提高貝類肉量、未來抗特定病源(specific pathogen-resistant, SPR)的水產抗病精準育種,如建立白蝦基因編輯技術以開發抗白點症病毒(WSSV)等病毒性病原的抗病白蝦品系,以及抗吳郭魚湖泊病毒(TiLV)的抗病品系,進行有關免疫系統功能和促進生長發育方向的研究。
基因編輯精準育種
會為水產市場帶來什麼影響?
龔紘毅說明,基因編輯除了加速育種,還可以選育出多種不同的性狀,在經濟型水產生物的應用主要包含成長促進、性別決定調控、不孕技術、體色改變、提升養殖存活率、抗病毒、抗逆境及提高營養價值等,具有無窮的開發潛力。而且由於 CRISPR�Cas9 技術相對簡單,只要能熟悉重要經濟物種的繁養殖技術,就有機會率先搶佔商機,使得育種產業進入百花爭妍的時代,不再像過去一樣只侷限在大型育種公司,許多新創公司也漸漸展露頭角。
那麼臺灣具有哪些優勢呢?龔紘毅表示,臺灣原本就是水產大國,擁有先進的繁養殖知識,人才和技術都是臺灣在水產精準育種上的優勢。然而臺灣現在還沒有適度監管基因編輯技術相關產品、產業的合適法規,即便已有像壯鯛一號這樣具產業競爭力的新品系出現,但因沒有法規可依循,距離上市仍有一大段路要走。
關於基因編輯生物和產品的管制,最大的爭議來自於基因編輯生物是否應視作 GMO。GMO 因為涉及外源基因的插入而受到法規嚴格監管,並需要進行額外的安全性評估,確認其產品安全無虞才可上市。而基因編輯因應 DNA 修復機制的不同,基因編輯可分成 SDN-1、SDN-2、SDN-3 等三類:SDN-1不引進外源基因直接修復 DNA 斷裂的地方而產生隨機突變,可不視為 GMO,是基因編輯主要應用到精準育種的技術;SDN-2 在修復時以生物體內的短片段相似 DNA 作為模板;SDN-3 則以大片段供體 DNA 作為模板,修復後的基因會帶有一段外源非原始基因的片段,即為 GMO。因此三種機制的產物無法一概而論。
推廣基因編輯精準育種的支持者認為,如果基因編輯不涉及外源基因插入,本質上與目前具有長久安全使用歷史的傳統育種技術(如自然突變、化學誘變)相同,只是加速遺傳變異產生,不應被視為 GMO 管制,應根據科學事實放寬限制,採行諮商程序進行評估,加速推動臺灣優秀的研發產品上市,與國際接軌。反對方則認為只要有基因工程的介入,都屬於廣義的基因改造。由於一般民眾對基因編輯生物技術不甚了解,因此如何進行公眾溝通,讓民眾理解這些新興育種技術的本質以及食用安全性,也是臺灣推動基因編輯技術入法時碰上的一大挑戰。
借鏡日本、放眼國際
2021年日本筑波大學與 Sanatechseed 公司合作開發的「高GABA 番茄」上市,這是日本第一個上市的基因編輯產品。其次,京都大學與近畿大學合作,也發表運用基因編輯技術改良的高取肉率真鯛品種,並隨即成立 Regional Fish 新創公司向有關機關申請販售許可。日本厚生勞動省在專家會議上認定採用 SDN-1 基因編輯非基因改造,不屬基因改造管理範疇,在2021年迅速地獲准銷售流通。
「日本身為水產大國,很早就看到基因編輯、全基因體定序等基因體技術,將對農業及水產養殖產業有很大的幫助。」龔紘毅說道,日本政府不但從幾年前就超前部署擬定跨機關政策、制定相關法規, 而且致力向國民宣傳何謂基因編輯技術,盡力做好公眾溝通,企業也自主在基因編輯食品上標示,保障民眾知的權利,消除大眾的不信任。這些做法都十分值得臺灣參考學習。
總結來說,國際上針對基因編輯產品及產業到底算不算作 GMO,判斷標準可分為製程導向和產品導向兩大類。製程導向以歐盟(Europe Union, EU)為代表,管制範圍包含技術、中間產物和最終產品, 一旦曾採用基因工程就屬於 GMO;以產品導向為管理依據的包含美國、日本、加拿大、澳洲等國,只從最終產品是否含有外源基因來認定。
基因編輯精準育種的未來展望
歐盟法院曾在 2018 年判定對基因編輯施行嚴苛的管制,引起歐洲各地學界和產業界極大的聯名反彈,各界擔憂落後的法規會限制國內科技應用的發展。龔紘毅提到,歐盟執委會(European Commission) 已於 2021 年 4 月 29 日公布「歐盟法律下之新興基因體技術現況」報告,認可使用基因編輯的精準育種符合綠色新政核心策略、轉型永續性糧食體系,且基因編輯技術的風險等同於傳統育種,不應視為 GMO 監管,應使民眾多了解,收集民眾意見加以評估。歐盟預計於今(2023)年可望修改管制方向,同意在不引進外源基因的情況下,以基因編輯精準育種可視同傳統育種管理。
至於部分民眾擔憂脫靶效應(off-target effects)衍生出的基因編輯食品安全性問題,龔紘毅回應:「脫靶效應產生非預期重要基因的突變,在傳統育種的 自然突變或隨機誘變技術一樣有可能出現,以現在基因編輯技術的高精準度即便真的發生了,也可以如傳統育種透過性狀的選育篩選,真正留下的都是只帶有特定有益性狀的子代。」他補充,藉由基因編輯技術實現單性繁殖,也為傳統養殖避開投餵性激素後可能的殘留風險、或是避免另一性別被銷毀(如蛋雞的雄性小雞),甚至有益於動物福利。
最後,龔紘毅也呼籲,儘管以基因編輯技術作為新興的精準育種方法需要法規適當監管,但過度嚴苛的管理不僅將導致行政效率低落,學界和業界人員也會無所適從。當日本、美國等先進國家都採用較開放的態度面對基因編輯產品時,臺灣也應選擇前進,盡快確立相關法規,並扶持、鼓勵國內產業發展,而非選擇後退、故步自封,以免未來農業與水產生物技術相關人才和技術外流。臺灣在農業與水產生技的研發能量充足,但仍需擁有合宜的法規, 才能為臺灣提升國際競爭力,並享受科技帶來益處與價值。