- 科技報導
- 生醫先鋒
文章專區
2025-11-15狂犬病防治前沿 疫苗改良與免疫新策略
527 期
Author 作者
陳淵銓/仁德醫護管理專科學校助理教授
狂犬病(Rabies)是一種由狂犬病毒(Rabies virus)引起的人畜共通傳染病(zoonosis),主要透過受感染動物(例如犬、蝙蝠等)咬傷或抓傷傳染。發病後會出現興奮、恐水症(Hydrophobia)、抽搐等症狀,最終導致死亡,目前可以透過暴露前(pre-exposure)與暴露後(post-exposure)預防來防範。而預防的有效策略則包括暴露前和暴露後的疫苗接種,暴露前免疫接種主要用於預防動物狂犬病;對於人類而言,則是暴露後免疫接種的臨床應用較多。儘管狂犬病疫苗已被廣泛使用且安全有效,但現今仍存在一些影響疫苗推廣的缺點、限制或挑戰。因此,仍須開發更有效、方便、安全及廉價的狂犬病疫苗。
狂犬病毒的簡介
與大多數病毒不同,狂犬病是透過神經元傳播到全身,而不是經由血液或淋巴系統。狂犬病毒的傳染性顆粒(virion)呈類似子彈的圓柱形,外圍具有外套膜,基因組由反鏈單股RNA(negative sense, linear single-stranded RNA, ssRNA)組成。病毒基因組包括五個高度保守的基因,分別為核蛋白(nucleoprotein, N)、磷蛋白(phosphoprotein, P)、基質蛋白(matrix protein, M)、醣蛋白(glycoprotein, G)和大型結構蛋白(large structure protein, L),如圖一所示。ssRNA與N蛋白結合,遺傳訊息被包裝為核糖核蛋白複合物(ribonucleoprotein complex),P蛋白則與L蛋白相互作用形成RNA複製酶(RNA dependent RNA polymerase)。這些結構蛋白的協同作用,確保狂犬病毒的複製、感染和逃避宿主免疫系統,使它能在神經系統中傳播。另外,芮格利小體(Negri body)是狂犬病毒核蛋白在宿主細胞內聚集形成的嗜酸性包涵體(inclusion body),廣泛分布於患者的中樞神經細胞內,會對宿主細胞造成傷害,是感染狂犬病毒的典型特徵,也可作為狂犬病診斷的指標。
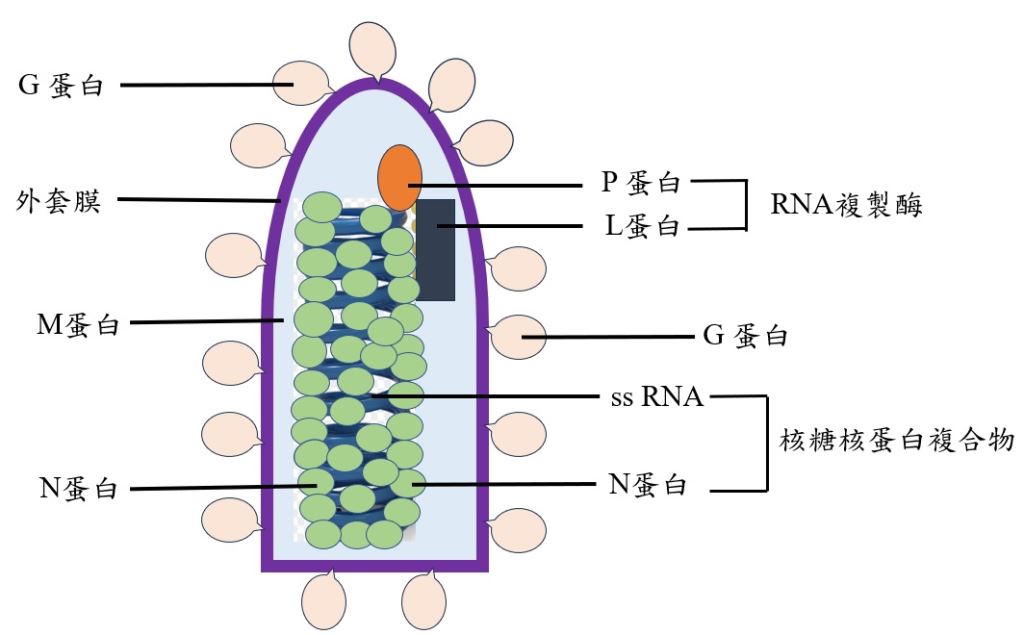
圖一|狂犬病毒顆粒的結構 (作者提供)
狂犬病動物疫苗
世界上最早的狂犬病疫苗由法國生物學家巴斯德(Louis Pasteur)在1885年研製成功,它是由兔子脊髓乾燥均質液(homogenate)製備而成的不活化疫苗(inactivated vaccine)。此外,他還發明了一種活性減毒疫苗(live attenuated vaccine),只是乾燥一天的脊髓均質液仍含有活的狂犬病毒。在1950年代,使用雞胚細胞培養病毒的不活化疫苗開始被廣泛應用,此時期的狂犬病疫苗也用於人類,特別是用於病毒暴露後的緊急預防或治療。而傳統的動物狂犬病疫苗則主要分為三類:不活化疫苗、活性減毒疫苗及重組疫苗,其中不活化疫苗被廣泛應用於家養動物和寵物,而活性減毒疫苗通常用於控制野生動物的狂犬病。近來,隨著生物技術和免疫學的進展,動物疫苗的製備方法發生了巨大的變化,各大藥廠已經開發或正在開發一些新型疫苗。
● 使用含佐劑(adjuvant)的不活化疫苗
去(2024)年,俄羅斯的生物工業科學研究與技術研究所(All-Russian Scientific Research and Technological Institute of Biological Industry)的研究人員評估在小鼠體內添加重組鼠傷寒沙門氏桿菌(Salmonella typhimurium)的鞭毛蛋白(flagellin)作為佐劑是否會增強不活化狂犬病疫苗的保護力。他們使用不活化疫苗「Rabikan®」,再加上不同濃度的佐劑進行研究,並以同系列不含佐劑的不活化疫苗作為對照組,再利用美國國家衛生研究院(National Institutes of Health, NIH)效力測試評估了不活化疫苗的保護活性。他們發現添加佐劑的狂犬病疫苗比活性(specific activity)(48.69 IU/mL)〔註〕明顯高於未添加佐劑的疫苗比活性(3.75 IU/mL)。這項研究顯示,重組鞭毛蛋白有潛力作為狂犬病疫苗的有效佐劑。
〔註〕每毫克蛋白質所含的酵素活力單位數。
同樣在2024年,中國南開大學化學院高分子化學研究所的研究人員開發單次注射疫苗以減少接種次數。首先,他們以狂犬病毒G蛋白作為抗原設計疫苗,並採用一種透過動態逐層薄膜作為可溶性塗層來進行時間控制及釋放的系統,讓G蛋白能多次脈衝(pulsatile)釋放。在小鼠的實驗中,他們發現與對照組的多劑量普通疫苗相比,單次注射疫苗可誘發更強的體液性(humoral immunity)和細胞性免疫反應(cell-mediated immunity)。此外,他們也設計了第二種以香菇多醣(lentinan)作為佐劑的單次注射疫苗,發現與對照組的多劑量普通疫苗相比,這種單次注射疫苗也能引發了更強的體液性和細胞性免疫反應。不僅如此,這個研究也顯示了第二次單次注射疫苗比第一次單次疫苗能引發更多的免疫反應,抑制狂犬病毒的效果更好,而研究團隊推測這可能與香菇多醣體佐劑增強免疫反應有關。
● mRNA疫苗
2023 年,瑞典斯德哥爾摩國際和平研究所(Stockholm International Peace Research Institute, SIPRI)和卡羅林斯卡學院(Karolinska Institutet)的研究人員使用兩劑由脂質奈米粒子配製、內含狂犬病毒醣蛋白G(Rabies virus glycoprotein G, RABV-G)的mRNA疫苗,施打在靈長類動物體內,用以誘導血液中的RABV-G特異性漿母細胞(plasmablast)、T細胞(T cell)及骨髓中的漿細胞(plasma cell)。他們發現與接種兩劑已上市的狂犬病疫苗Rabipur®相比,接種mRNA疫苗可誘發更多的狂犬病毒特異性漿母細胞和T細胞產生。此外,mRNA疫苗誘發可與RABV-G結合的中和抗體效價(titer)明顯高於Rabipur®。這個研究證明mRNA疫苗可以誘發更高的抗體效價,並用以改善相關麗莎病毒株(lyssavirus strain)的交叉中和作用(cross-neutralization),使mRNA有潛力成為具廣泛保護性的狂犬病疫苗的平臺。
狂犬病人用疫苗
目前人類最常使用的狂犬病疫苗是不活化疫苗,接觸狂犬病毒後應立即接種疫苗,接種策略主要有兩種:暴露前預防及暴露後預防。暴露前接種疫苗可以保護狗、寵物及家畜免受狂犬病毒感染,從而降低人類感染的風險。此外,經常與動物接觸的人類(例如獸醫、動物救援人員或畜牧場工作人員等)也建議作暴露前疫苗接種。然而,暴露後接種疫苗是一般民眾的重點策略,被可能帶有狂犬病毒的動物咬傷或抓傷的人應立即清理傷口,並注射狂犬病疫苗。此外,被高度懷疑患有狂犬病的患者須及時進行暴露後免疫球蛋白注射和疫苗接種,以防止病毒進入中樞神經系統。目前用於人類和動物狂犬病暴露後預防的疫苗或免疫球蛋白主要分為三類:
1. 細胞培養疫苗(cell culture vaccine, CCV):包括人類二倍體細胞培養狂犬病疫苗(Human diploid cell culture rabies vaccine, HDCV)、倉鼠腎細胞疫苗(Hamster kidney cell vaccine, HKCV)、非洲綠猴腎細胞疫苗(Vero cell vaccine)和純化雞胚細胞培養狂犬病疫苗(Purified chick embryo cell culture rabies vaccine, PCECV)。
2. 抗狂犬病血清(serum):含有特異性免疫球蛋白的製劑。
狂犬病疫苗接種是預防人類被狂犬病毒感染的有效方法,但現階段仍存在一些影響甚至阻礙疫苗推廣的缺點,例如免疫反應不完全、副作用、需要多劑量接種、費用高昂、疫苗供應不足及需要冷鏈保存等。儘管人類用狂犬病疫苗已使用多年,但在特定情況下,疫苗仍然無法保護某些患者。因此,需要開發新型疫苗,以改善延遲的抗體反應和微弱的細胞性免疫,提供更全面的保護。所以近年來,更有效、安全、耐熱且成本低的人用狂犬病疫苗正積極開發中。
(1)使用Vero細胞製備的疫苗:
因為Vero細胞不含人類細胞成分,且殘留DNA含量低,所以被廣泛應用於預防病毒感染的疫苗生產,例如純化Vero細胞培養凍乾狂犬病疫苗(Purified Vero cell-cultured freeze-dried rabies vaccine, PVRV)。以下是成功的臨床試驗案例:
2023年,中國武漢國家聯合疫苗工程技術研究中心的研究人員開發了一種使用Vero細胞製備的狂犬病候選疫苗(PVRV-WIBP),並評估它用於人類的安全性和免疫原性。在第三期的臨床試驗中,研究人員分別在第一階段(40名)和第二階段(1956名)招募年齡介在10~50歲之間的受試者。為了進行安全性評估,第一階段的受試者分成兩組,分別接受4劑或5劑PVRV-WIBP。而在第 2 階段,1956名受試者被隨機分成三組,分別接受4劑 PVRV-WIBP、5劑 PVRV-WIBP 和5劑已正式上市的對照組疫苗(PVRV-LNCD)。他們在接種疫苗後第7天或第14天、第35天或第42天測量血清中和抗體的效價。試驗結果顯示,與PVRV-LNCD組相比,PVRV-WIBP組(4劑或5劑)的受試者表現出更高的中和抗體效價,而且PVRV-WIBP誘導的免疫反應與PVRV-LNCD幾乎相同,並且在10~50歲的受試者中耐受性良好。此外,他們記錄不良事件超過6個月,在PVRV-WIBP(4劑和5劑)及PVRV-LNCD組中,他們發現大多數不良反應都很輕微。這項研究顯示,PVRV-WIBP(4劑和5劑)可以作為暴露後預防的替代疫苗。
(2)結合Vero細胞的狂犬病疫苗及人類狂犬病免疫球蛋白
世界衛生組織(World Health Organization, WHO)及美國疾病控制及預防中心(Centers for Disease Control and Prevention, CDC)均建議狂犬病毒暴露後應立即傷口清洗、注射人類血源性狂犬病免疫球蛋白(huma rabies immunoglobulin, HRIG)及4劑疫苗進行預防。HRIG僅在暴露後注射一次,並且僅適用於先前未接種過疫苗的人。HRIG可提供即時的抗體保護,直至患者能夠主動產生抗體,但一些研究顯示HRIG可能會干擾狂犬病疫苗的免疫原性(Immunogenicity)。因此,近期研究嘗試將無血清、高純度的Vero狂犬病疫苗(PVRV-NG)和HRIG聯合治療,而動物實驗和臨床試驗中目前也顯示不錯的應用前景。
2024 年,法國賽諾菲(Sanofi Pasteur)製藥公司的研究人員開發了下一代狂犬病疫苗(PVRV-NG2),並與已許可上市的PVRV(Verorab®)和HDCV(Imovax Rabies®)疫苗做比較。他們評估HRIG肌肉注射及PVRV-NG的免疫原性和安全性,並在類似的暴露後預防模型與PVRV+HRIG和HDCV+ HRIG進行比較。在這項雙中心、雙盲的第三期臨床試驗中,年齡大於18歲的健康成年人(N = 640)以3:1:1:1 的比例隨機分配到 PVRV-NG2+HRIG、PVRV+HRIG、HDCV+HRIG及單獨 PVRV-NG2共4組中,並分別在第0、3、7、14天接種單劑疫苗,而單劑HRIG則皆在第0天就進行接種。他們分別測定接種疫苗後第0、14、28和42天的狂犬病毒中和抗體(rabies virus neutralizing antibody, RVNA)效價,發現所有受試者的RVNA效價均大於或等於0.5 IU/mL,結果顯示與PVRV+HRIG和HDCV+HRIG相比較,PVRV-NG2+HRIG的RVNA效價並不會比較差。他們也評估了各組最後一次注射後6個月的不良事件,也發現PVRV-NG2的安全性與其他組類似。綜合研究結果顯示,PVRV-NG2+HRIG的免疫原性和安全性與目前用於暴露後預防的標準狂犬病聯合療法幾乎相同。因此,PVRV-NG2+HRIG有可能成為人類狂犬病的聯合療法。
(3)使用單株抗體結合體
由於HRIG的供應有限、可能干擾疫苗的免疫原性及具潛在的安全顧慮,所以也有些學者建議以新興的單株抗體組合取代傳統的HRIG。
2024 年,中國北京國家藥品監督管理局的研究人員透過混合兩種非競爭性、非重疊的人類單株抗體RM02和RM05(1:1),開發了單株抗體組合CRM25。他們發現CRM25可以交叉中和狂犬病毒株,並抑制所有測試的狂犬病毒和非狂犬病毒種系I麗莎病毒的感染。動物實驗顯示,與HRIG相比,CRM25可以保護敘利亞金黃倉鼠(Mesocricetus auratus)免受致命狂犬病毒的攻擊。研究結果顯示,CRM25可能成為未來臨床試驗中狂犬病暴露後預防的潛在治療候選藥物。
疫苗改良與全球免疫,是消除狂犬病的的關鍵
由於狂犬病毒一旦侵入中樞神經系統,幾乎無法存活,因此預防感染非常重要。隨著疫苗技術的發展,目前動物狂犬疫苗在免疫效力、安全性和生產效率方面已有長足進步。但疫苗接種覆蓋率和全球免疫戰略仍需推進。只有透過全球合作、提高疫苗接種率和實施有效的控制策略,才能消除動物狂犬病的威脅。
延伸閱讀
1. Hellgren, F. et al. (2023). Unmodified rabies mRNA vaccine elicits high cross-neutralizing antibody titers and diverse B cell memory responses. Nat. Commun, 14, 3713.
2. Huang, X. et al. (2023). Safety and immunogenicity of rabies vaccine (PVRV-WIBP) in healthy Chinese aged 10–50 years old: Randomized, blinded, parallel controlled phase III clinical study. Hum. Vaccin. Immunother, 2023, 19, 2211896.
3. Pineda-Peña, A.C. et al. (2024). Immunogenicity and Safety of a Purified Vero Rabies Vaccine-Serum Free, Compared With 2 Licensed Vaccines, in a Simulated Rabies Post-Exposure Regimen in Healthy Adults in France: A Randomized, Controlled, Phase 3 Trial. Clin. Infect. Dis., 78, 1748–1756.