- 科技報導
- 生醫先鋒
文章專區
2025-07-15開啟新世代基因編輯技術的大門 更具彈性與多樣性的TIGR/Tas系統
523 期
Author 作者
陳淵銓 / 仁德醫護管理專科學校助理教授
近幾年來, CRISPR/Cas已發展成基因編輯領域的核心技術,在基礎科學研究、醫藥及農工業等領域應用廣泛,但局限性及安全性也逐漸浮現。今(2025)年發表於《科學》(Science)期刊的一項研究揭示了串聯間隔嚮導RNA標靶系統(tandem interspaced guided RNAtargeting system)展現出超越CRISPR的潛力,這種系統作為一種潛在替代平臺,具備更高的靶點選擇自由度與模組化設計優勢,雖有眾多挑戰待解決,但仍有可能成為極具展望性的基因編輯新技術。
TIGR/Tas系統的發現與演化
TIGR /Tas(tandem interspaced guided RNA /TIGR associated protein)是神經生物學家張鋒研究團隊透過生物資訊分析寄生細菌與噬菌體基因組時,發現的一種DNA(deoxyribonucleic acid,去氧核糖核酸)標靶機制。這個RNA(ribonucleic acid,核糖核酸)引導的DNA標靶蛋白家族,由TIGR陣列和含有核仁蛋白結構域(nucleolar protein domain, NOP domain)的TIGR相關蛋白(TIGR associated protein, Tas)組成。研究團隊在眾多未知蛋白家族中識別出一群與RNA導引相關的基因,隨後進一步發現具備RNA導引的DNA標靶能力,在演化上雖然獨立於CRISPR/Cas,但功能上具高度相似性。系統結構與工作機制包含三大模組:
1. 嚮導RNA(guid RNA, gRNA)模組:串聯倒置基因組重複序列(tandem inverted genomic repeat)是一段能與標靶DNA序列互補的RNA,負責標靶點辨識。
2. 蛋白效應模組:標靶相關蛋白是一個類似Cas蛋白的結構蛋白,但具更多功能,例如轉錄抑制、RNA修飾及dsDNA(double stranded DNA,雙鏈DNA)斷裂等。
3. 標靶複合體模組:Tas蛋白與RNA共同形成的複合體,能精準導引至特定DNA位點;TIGR/Tas系統不依賴指定基因(protospacer adjust motif, PAM)序列,並透過多重蛋白質亞基 (protein subunit)間的協同作用,展現更高的標靶彈性與功能多樣性。
TIGR/Tas的特性
早在2013年,張鋒團隊便將CRISPR/Cas9改進並應用於哺乳動物細胞,掀起了基因編輯革命。十年來,CRISPR/Cas技術已被廣泛應用於生物醫學領域,並催生出全球首款基因編輯療法來治療鐮刀型細胞貧血病,但是CRISPR/Cas在作用時仍有許多限制,例如脫靶效應(off-target)與免疫反應等方面仍存在局限性,以及CRISPR/Cas切割時依賴特定PAM序列,無法標靶基因組的所有位置。而且Cas分子量較大,難以透過非病毒載體遞送。
因此,張鋒團隊便開發了一種全新的RNA引導基因編輯系統TIGR/Tas,這一系統比 CRISPR/Cas更靈活,並具有更高的標靶自由度與更低的遞送門檻,為基因編輯領域帶來革命性發展。特點如下:
1. 無PAM序列限制:TIGR/Tas標靶無需PAM序列識別標的DNA序列,能作用到範圍更廣的基因區域。
2. 雙間隔標靶機制:TIGR/Tas透過兩個RNA間隔區辨識dsDNA,可以更精確切割且提高編輯精準度。
3. Tas蛋白較小:TIGR/Tas只需要一個比Cas蛋白更小的Tas蛋白,適合包裹於非病毒遞送系統,例如奈米粒子和類病毒粒子載體,不像CRISPR/Cas往往需包裹於病毒遞送系統,例如腺病毒相關病毒(adeno-associated viruses, AAV)。因此TIGR/Tas使用於人體治療的可行性更高。
4. Tas蛋白具多種功能:Tas蛋白可分為多種,各具不同功能,例如TasA會與RNA結合但無切割功能,可用於基因調控;TasH、TasR具備核酸酶活性,可進行基因編輯,目前TasR被引入人類細胞後,可成功誘導基因編輯,效率最高達3.6%。因此,TIGR/Tas不只是可用在dsDNA切割的基因編輯工具,還能用於基因調控及鹼基編輯等。
TIGR/Tas與CRISPR/Cas相同處及相異處比較如下表:
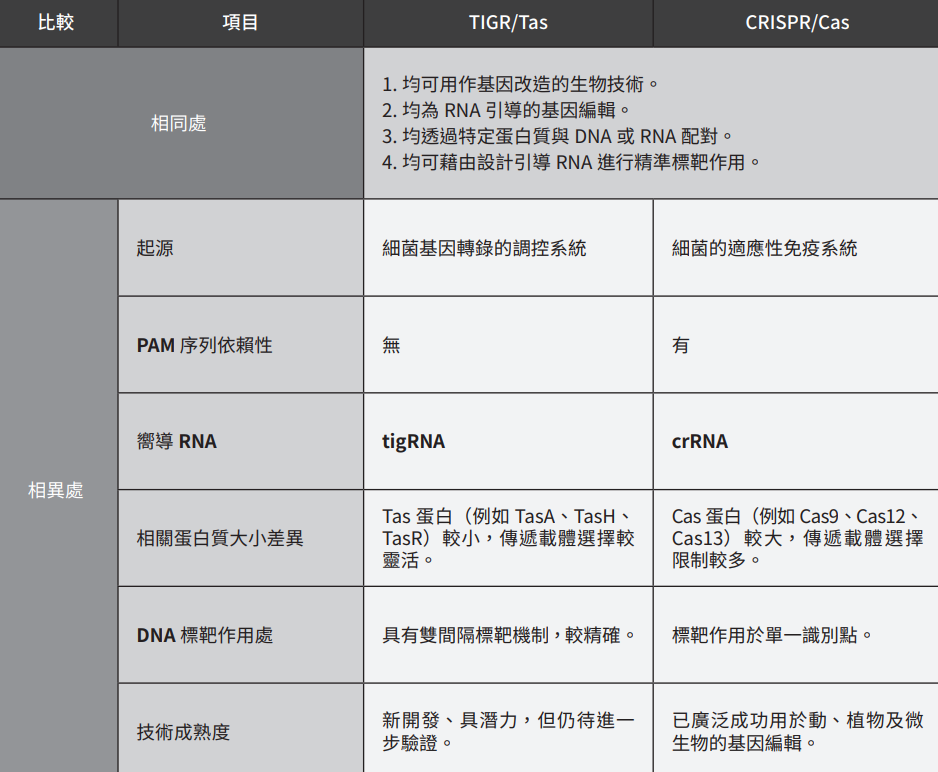
表一 | TIGR/Tas 與 CRISPR/Cas 比較(資料來源:作者提供)
TIGR/Tas的前景與挑戰
TIGR / Tas的出現具有多重意義,不僅對基礎科學認識及微生物演化研究有啟發,也對生物技術的應用帶來潛力。以下是五大核心意義:
1. 揭示RNA引導機制的多樣性:以往RNA引導的DNA操作系統幾乎只限於CRISPR/Cas,但TIGR/Tas的發現顯示了RNA可以透過不同方式指導DNA的定點辨識與修飾。這類RNA引導系統可能不止一種,而是演化上廣泛出現的策略,表示自然界或許還有更多尚未發現、天然存在的RNA-DNA操控機制。
2. 擴展基因編輯工具庫:Tas蛋白的模組性與可編程性,使它能夠進行高特異性的DNA切割,可在人類細胞中被重新設計與使用,不依賴CRISPR/Cas的重複序列與蛋白結構。因此,它可能成為新一代基因編輯平臺的候選者,解決現有技術的一些瓶頸,例如脫靶效應、免疫反應等,帶來CRISPR以外的新一代精準基因工具。
3. 提供病毒如何操控宿主的線索:噬菌體等病毒本身也攜帶TIGR/Tas系統,因此病毒可能藉此對抗宿主的免疫系統或操控宿主基因組,以利於自身複製、防禦其他競爭性病毒,也就是病毒之間的「軍備競賽」。這將會成為病毒基因編輯武器化的可能性。
4. 增加對生物分子演化的理解:Tas蛋白與小核仁核糖核蛋白(small nucleolar ribonucleoprotein, snoRNP)、IS110 RNA引導轉座酶(transposase)系統的轉位子(transposon)結構相似,意味著RNA引導功能可能在不同的生物類群中經歷過多次獨立演化。這也揭示蛋白質-核酸複合體的可塑性與重複利用性,將有助於理解核酸與蛋白的互動如何塑造出複雜生命功能。
5. 推動合成生物學與人工生物系統設計:TIGR/Tas的模組化架構(RNA加上可變蛋白)非常適合構建可編輯、可訂製的分子機器,與CRISPR、鋅指核酸酶(zinc-finger nucleases, ZFNs)、類轉錄活化因子核酸酶(transcription activator-like effector, TALE)等其他基因編輯技術結合,創建人造基因網路、控制代謝途徑,或設計智慧治療病毒。
TIGR/Tas在應用上因為沒有PAM限制,可以精準編輯更廣泛的基因區段,尤其適合應用於人類較難編輯的區域,例如端粒與重複序列等。與Cas蛋白相比,Tas蛋白質分子量較小,所以理論上TIGR/Tas免疫原性較低,且較易包裹於傳遞載體中,引起的免疫反應較小,載體選擇也較容易,應用在人體治療的有效性及安全性較高,有相當潛力應用於嵌合抗原受體T細胞(chimeric antigen receptor T cells)、自然殺手細胞(natural killer cell )等免疫療法及基因治療。此外,TIGR/Tas的模組化設計有利於建構可編程細胞邏輯(programmable cellular logic),也就是利用合成生物學與基因工程的方法,讓細胞能夠像電腦一樣根據輸入做出「且(AND)/「或」(OR)」等邏輯運算與決策,選擇最適合的組合模式,藉此控制細胞的行為,例如表達特定蛋白質、殺死癌細胞、產生代謝物等。
然而,TIGR/Tas是否能夠實際應用,仍有以下挑戰待解決:
1. 功能解析仍在初步階段:雖然目前已確認TIGR/Tas對DNA的標靶能力,也已經解出並發現TasR蛋白結構類似snoRNP與轉座酶結構,但它的結構域功能與調控仍有待進一步研究。例如嚮導RNA如何準確配對並啟動Tas活性、TIGR陣列如何被加工與調控、Tas蛋白的目標識別與啟動機制是否涉及輔助因子等。
2. 缺乏標準化工具箱:CRISPR/Cas已有豐富的編輯、抑制與活化元件,而TIGR/Tas的相關資源仍待建立。
3. 編程能力尚未成熟:與CRISPR /Cas9 相比, TIGR/Tas的編程與可塑性雖有初步優勢,但目前的研究仍處於早期階段,因此引導RNA設計規則尚不明確、Tas蛋白的工程化能力與效率尚未接受系統性評估,目標選擇與脫靶效應的評估也缺乏大型資料庫作為佐證。
4. 免疫原性與安全風險:如同CRISPR /Cas9一樣,來自細菌或病毒的外源蛋白進入哺乳動物細胞後,可能被免疫系統辨識為外來物而引發免疫反應,引起過敏反應、自體免疫疾病或其他副作用,也可能造成不可預期的DNA創傷或染色體重組。
5. 生物演化與穩定性問題:TIGR/Tas可能是某些細菌或病毒演化出來的特有武器,代表它的功能特異性雖強,但穩定性較差,因此仍需評估它在異種生物或人類細胞中長期表達的穩定性。系統是否有自我限制或調控機制目前仍不清楚,長期應用則需注意生物穩定性與風險管控。
6. 臨床應用需更多的試驗:TIGR / Tas是否能夠實際應用於人體,仍需更多臨床試驗來評估,包括載體傳遞效率、安全性測試、長期穩定性及免疫反應等皆需長期評估。
TIGR / Tas的發現代表著RNA導引核酸標靶系統的新篇章,不僅是一項生物學上的突破,更可能為基因編輯、病毒學、演化及合成生物學等領域帶來新革命。TIGR / Tas系統的可模組化、可程式化及無PAM序列限制的特性,使TIGR / Tas有潛力補足,甚至在特定應用中超越CRISPR /Cas系統。未來可以結合人工智慧(artificial intelligence, AI)蛋白設計與結構預測進行TIGR / Tas工程最佳化,建立跨物種通用編輯平臺,拓展相關技術在基礎醫學、醫藥及農工業領域的應用。隨著更多研究投入,TIGR / Tas或許有望成為下一個世代的基因編輯的顛覆性技術平臺。
延伸閱讀
1. Faure, G. et al. 2025. TIGR/Tas: A family of modular RNA-guided DNAtargeting systems in prokaryotes and their viruses. Science, 388, 6746.
2. Doudna, J. A. & Charpentier, E. 2014. The new frontier of genome engineering with CRISPR-Cas9. Science, 346, 6213.
3. Chen, P. J. & Liu, D. R. 2023. Prime editing for precise and highly versatile genome manipulation. Nature Reviews Genetics, 24, 161–177