- 封面故事
- 2025年
- 662期 - 狙擊禽流感(2月號)
文章專區
2025-02-04禽流感如何演變成全球性威脅?
662 期
Author 作者
趙黛瑜 | 中興大學獸醫學院微生物暨公共衛生研究所、中興大學微生物基因體學程、中興大學醫學院後醫學系教授。
Take Home Message
• A 型流感病毒的自然宿主是遷徙性海鳥,病毒主要在牠們的腸道複製並排出,再被其他海鳥食入或吸入傳播。
• 病毒的高病原性、強致病力源自它的高突變性與基因重組特性。病毒在感染同一宿主細胞時可進行基因重組,再藉由野鳥遷徙發生全球性的傳播。
• 全球第三波重大疫情是由H5N1的分支引起,從2020 年至今未結束。疫情影響多種鳥類和哺乳動物,並引爆美國乳牛感染事件。
禽流感病毒,指的其實是A 型流行性感冒病毒(influenza A virus, IAV),也是一種RNA 病毒。但不要以為A 型流行性感冒病毒只會感染家禽,它還可以感染許多不同動物,包括豬、馬、狗、貓、人,甚至是海裡的哺乳動物,例如鯨魚。
發現海鳥身上的病毒
A 型流行性感冒病毒在20 世紀曾經造成三次全球大流行,包括1918 年的西班牙流感(Spanish Flu),1958 年的亞洲流感(Asian flu)及1968 年的香港流感(Hong Kong flu)。但在1970 年代前,人們對A 型流行性感冒病毒造成大流行的起源卻所知甚少,一直到1967 年才有所進展。
那年, 紐西蘭知名病毒學家韋伯斯特(Robert Webster) 走在澳洲新南威爾斯州(New South Wales)的海灘時,看到海灘上遍布海鳥的屍體。他想到1961 年南非曾報告過多起A型流行性感冒病毒案例,這應該是A 型流行性感冒病毒闖的禍;另外他也意識到,原來科學界對海鳥身上帶有哪些病毒其實一無所知。自此,韋伯斯特開始了海鳥A 型流行性感冒病毒的野外調查工作,後來才確定了遷徙性海鳥就是A 型流行性感冒病毒的自然宿主,這些遷徙性海鳥感染不同亞型的A 型流行性感冒病毒卻完全沒有出現症狀,且病毒主要在腸道進行複製,並經由腸道排出、進入環境中,再進一步由其他不同種的海鳥食入或吸入,造成嚴重疫情(圖一)。
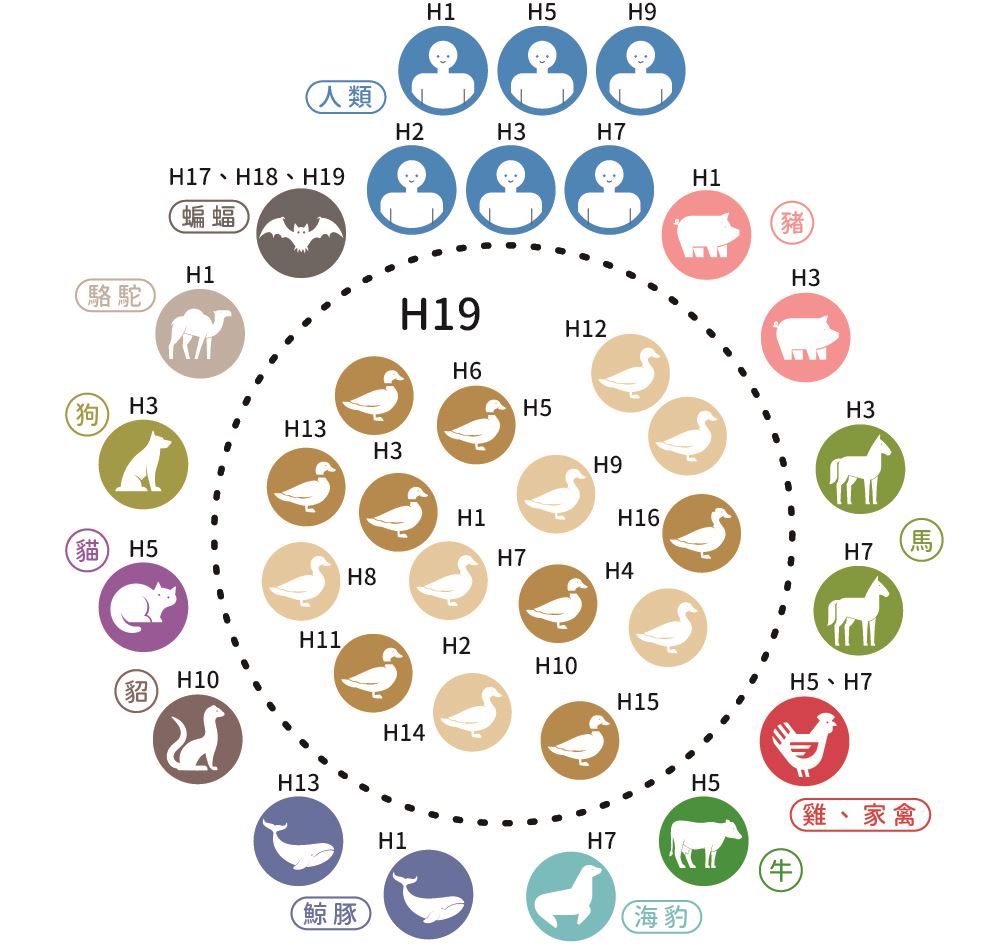
圖一| A 型流行性感冒病毒的自然宿主與不同亞型感染的已知宿主分布
A 型流行性感冒病毒的表面帶有兩種結構蛋白,分別為血球凝集素(hemagglutinin, HA)與神經胺酸酶(neuraminidase, NA)。HA 具有凝集紅血球的特性,NA 具有裂解細胞上唾液酸的功能,兩種蛋白均有抗原性。目前已知HA 共有18 種血清型;NA 共有11 種血清型,不過流行於全世界野生水鳥體內的只有16 種HA 與九種NA。2008 年,科學家曾在中亞哈薩克的野鳥紅頭潛鴨(Aythya ferina)中找到一株全新的禽流感病毒,目前已知是全新的H19 亞型,但NA 的型別仍不清楚,科學家推測此病毒可能是由蝙蝠傳播到野鳥。
根據HA 與NA 的不同,可以進一步將A 型流行性感冒病毒分成144 種亞型,以H 和N 加上亞型的數字表示, 例如H1N1。雖然遷徙性海鳥是A 型流行性感冒病毒的自然宿主,但並非所有海鳥均帶有所有的亞型病毒。鳥類中以雁形目(Anseriformes)的水鳥帶有的亞型種類最多,而鴴型目(Charadriiformes)的水鳥,尤其是鷗科的鳥則以H13 或H16 的亞型為主。
病毒的基因與致病性演變
流行性感冒病毒的基因組成為負向單股RNA,且具有八個獨立的基因片段,這些特性使病毒基因的演變分為兩種:一種為氨基酸的突變,主要是基因片段發生氨基酸的突變、插入或刪除,若發生在主要的HA 或NA 蛋白上,可造成抗原飄移(antigenic drift),例如每年都要重新施打季節性流感疫苗,就是因為病毒常常發生抗原飄移所致,另一種為基因重組,主要發生在不同病毒感染同一個宿主的同一個細胞時發生,若發生在主要的HA 或NA 蛋白上,又稱為抗原轉換(antigenic shift)。當重組的病毒出現特定物種的適應性改變,就有機會傳給不同物種,例如 H3N8 就能傳染給馬,因此又稱馬流感病毒。野生水鳥有特定的遷徙路徑,因此科學家可以透過病毒的基因體定序,判斷該基因片段是來源自歐亞或美洲的水鳥。
由於家禽屬於鳥類,因此最容易受到水鳥身上攜帶的各種亞型A 型流行性感冒病毒感染。一旦家禽(尤其是雞或火雞)出現大規模死亡,就代表病毒的毒力(致病力)已發生改變。科學家會根據兩種標準判定病毒的致病性:一、檢驗HA 基因序列是否帶有多個鹼性胺基酸的蛋白酶切割位;二、體內致病力試驗(intravenous pathogenicity test)將A 型流行性感冒病毒分為高病原性(high pathogenicity)和低病原性(Low pathogenicity)禽流感病毒。目前所有感染水鳥的144 種亞型的A型流行性感冒病毒都是低病原性的禽流感病毒,只有H5 和H7 兩種亞型出現了高病原性。
從1996 年至今- H5N1 的全球大流行
雖然在19 ~ 20 世紀期間也曾有高病原性病毒在禽場爆發流行,但爆發疫情的禽場數與撲殺的家禽數,都遠遠不及21 世紀後H5N1 的疫情規模。H5N1 病毒在1996 年首次從中國廣東省的家鵝中分離,屬於高病原性亞型H5N1 Gs/GD,並在1997 年傳至香港,甚至傳染至人類,造成18 人感染及六人死亡。雖然當時採取大規模家禽撲殺行動使疫情未繼續擴大,但病毒並沒有因此消失,而是藉由遷徙性野生水鳥於2003 年擴散至全球。
根據世界動物衛生組織(World Organisation for Animal Health, WOAH)的世界動物衛生資訊系統(WAHIS),演化自H5N1 Gs/GD 分支(clade)的禽流感病毒,從2000 年開始已在全球引發三波主要的疫情(圖二):
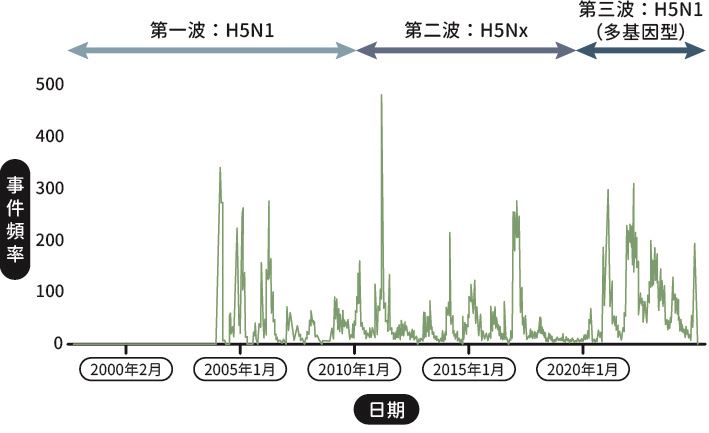
圖二| 1997 ~ 2024 年全球禽流感通報案例
( 資料來源: 聯合國農糧組織(Food and Agriculture Organization of the United Nations, FAO)全球動物疾病資訊系統(EMPRESS-i+))
第一波疫情發生於2003 ~ 2010 年,由H5N1 病毒引起。當時有超過5000 萬隻家禽死亡或被撲殺,疫情主要發生在亞洲國家,並累積超過800 人因直接或間接與受感染的家禽接觸而致病,死亡率高達53%。
第二波發生於2011 ~ 2019 年,與前一波不同的是這波流行的病毒主要由演化自H5N1 Gs/GD 屬於2.3.4.4 分支為主〔註1〕,且由H5 病毒的多種亞型(H5Nx)引起,包括H5N6、H5N8、H5N3等。疫情造成亞洲、歐洲、非洲和北美洲在此期間共有超過1 億3000 萬隻家禽死亡或被撲殺,同時也在全球發生許多禽傳人致死的案例,包括在中國傳播的H5N6,以及在俄羅斯傳播的H5N8 等。值得一提的是,這段時間有另一波H7N9 禽流感病毒大流行,但主要發生在中國。此病毒亞型一開始為低病原性,在家禽中的症狀並不明顯,導致許多與家禽活禽市場有直接關聯的人受到感染,累積超過1500 人通報,感染的患者死亡率約39%。後來此病毒也在約2016 年確認演變為高病原性,且在此期間,中國也陸續通報感染不同亞型的禽流感病毒的零星病例,包括H6N1、H7N2、H7N3、H7N4 、H7N7 、H9N2 、H10N7 等。
〔註1〕2.3.4.4 分枝於1996 年首次在中國廣東被發現,是高病原性禽流感病毒H5 亞型中的分支,例如2.3.4.4a、2.3.4.4b 等,目前分支已經紀錄到2.3.4.4h。
第三波疫情開始於2020 年秋季(至本文截稿為止尚未結束),主要由H5N1 病毒引起。與第一波的H5N1 疫情不同的是,此波H5N1 病毒的H5 雖然仍是來自於Gs/GD,但屬於2.3.4.4b 分支,而且容易與候鳥身上攜帶的不同低病原禽流感病毒進行重組,進而產生許多不同的基因型(genotype)〔註2〕。與第一、二波相比,第三波疫情造成的災情在更短時間內造成更多家禽的死亡或撲殺,主要疫情分布於歐洲、北美與少部分的亞州及非洲地區,且發生外溢效應〔註3〕,進一步感染了其他動物。
〔註2〕流感病毒具有八段分段的基因,八段基因可自由基因重組(reassortment),因基因重組來源的差異產生了不同的基因型。
〔註3〕指其他非雁形目與鴴形目的野鳥、家禽,甚至其他哺乳動物,因為生活在同一個棲地環境,在環境中存在大量高病原性病毒的情況下,受到感染並死亡。
A 型流行性感冒病毒的致病機制
HA 是決定病毒致病力的關鍵蛋白,它能使病毒入侵宿主細胞,但必須先被宿主體內的蛋白切割酵素分解成HA1 和HA2 才具有功能,而被切割的程度決定了病毒的致病力。HA 可被切割的程度又受到HA1 的C 端至切割位之間,具有多少鹼性胺基酸所影響。參與血球凝集素切割的蛋白酵素主要有類胰島素蛋白酶(trypsin-like protease)和類弗林蛋白酶(furin-like protease)。若HA 切割為所帶的鹼性胺基酸愈多,則愈容易貝多種蛋白酵素切割,也意味著病毒更容易感染呼吸道以外的器官,因此致病力愈強。
在低病原性的病毒中,HA 從宿主細胞釋放後呈現未活化狀態,且HA1 的C 端至切割位間只有兩個非連續性的鹼性胺基酸,此時只有類胰島素蛋白酶能進行切割。另外,由於類胰島素蛋白酶具有位置選擇性,一般體內外交界只出現於呼吸道和消化道,因此限制了病毒的攻擊範圍。
反觀高病原性的病毒生活史,HA 於感染細胞中組裝之前就已被切割,因此釋出宿主細胞後攻擊範圍不受限於類胰島素蛋白酶的位置。這是因為高病原性的病毒HA 具更多鹼性胺基酸,或在HA1 的C 端插入了其他的胺基酸序列,因此類胰島素蛋白酶和類弗林蛋白酶皆可能進行切割。而類弗林蛋白酶是一種廣泛存在細胞內的蛋白酵素,HA 可於釋出前就被活化。
病毒致病力的診斷標準
在病毒致病力的定義上,世界動物衛生組織WOAH 對於高病原性的定義如下 :
1. 10 隻4 ~ 8 週齡對A 型流行性感冒病毒具有感受性(susceptibility)〔註〕的雞,注射經十倍稀釋的病毒液0.2 毫升後,於十日內死去6 ~ 8 隻。
2. 任何A 型流行性感冒病毒的靜脈注射致病指數(intravenous pathogenicity index, IVPI)大於1.2 者。IVPI 的檢驗方法是讓10 隻4 ~ 8 週齡的雞接種禽流感病毒(HA 效價> 1/16),將病毒液稀釋十倍,每隻靜脈注射0.1 毫升,而後每24 小時觀察一次,連續觀察10 天。每天記錄雞臨床觀察的變數和加權數,分別為正常(0)、輕症(1)、重症(2)和死亡(3),最後將累計的加權數除以100得出。例如分數為3,表示所有受試雞於24 小時內死亡;若分數為0 則表示未有雞隻出現任何臨床症狀。
〔註〕具有感受性是指沒有經過免疫過,可被感染的個體。
此波H5N1 病毒已經影響了約80 種不同的鳥類,造成蘇格蘭40%的賊鷗(Skua)種群、希臘的2000 隻斑點鵜鶘(Dalmatian pelicans)死亡,對鳥類的生態保育造成極大的威脅。某些基因型也外溢感染海豹、狐狸、狸貓、雪貂等哺乳動物,且對不同地區的留鳥或物種具有適應性,藉由感染這些扮演橋接物種(bridging species)角色的動物,再傳播給其他陸生動物。最後,造成自去(2024)年至今在美國乳牛感染禽流感病毒的重大疫情。
病毒快速演化的可能原因
前面提到A 型流行性感冒病毒在20 世紀曾經造成三次全球大流行,第一次的全球大流行西班牙流感發生在1918 年,由H1N1 引起;第二次和第三次全球大流行則都起源自亞洲,分別是在1957 年由H2N2,以及1968 年由H3N2 引起。根據基因序列演化分析,此三次大流行的病毒均有來自禽流感病毒的基因片段,自然宿主是雁形目和鴴形目的野生鳥類。
這些低病原的禽流感病毒透過野生鳥類傳至家禽後,因為家禽數量龐大且飼養密集高而快速傳播,使RNA 病毒得以快速演化,進而篩選出高病原性的病毒,除了會造成家禽的死亡外,也會進一步回傳至野生鳥類,並產生三種影響:
1. 病毒的八段獨立基因具有基因重組的特性。由於野生水鳥為禽流感病毒的自然儲存宿主,HPAI 回傳野生鳥類後,可以在候鳥身上進一步與候鳥身上所攜帶的低病原禽流感病毒重組產生更多不同基因型,不同基因型對於不同物種可能具有不同的適應性與致病力,可能增加感染不同動物物種的機會,也可能造成不同物種的大量死亡。
2. 這些不同重組病毒也有可能感染豬後,進一步傳給人。由於豬身上同時帶有禽與人特有的受體,將會與人流感病毒基因發生重組。又或者經由重組病毒逐步增加對各種哺乳動物的適應性,而進一步傳給人,造成大流行的可能。
3. 高病原性病毒回傳至野生鳥類後,藉由候鳥遷徙造成跨洲傳播,促使全世界的禽流感病毒能擁有複雜的基因交換。藉由候鳥遷徙的過程,病毒透過受感染的鳥類糞便排出,感染其他共享遷徙路線與生存環境的鳥種,並進一步將病毒攜帶至世界各地。
各種重組病毒在野生鳥類群體中的傳播力取決於病毒在環境中的穩定性,以及不同鳥種間的接觸頻率。影響野鳥與禽場間的病毒傳播的因素有很多,包括同樣是雁形目與鴴形目的野鳥,對高病原禽流感病毒的耐受性不同,不同野鳥身上排出病毒的量也不同;不同野鳥有各自選擇棲地的習性,也可能受氣候變遷影響棲地環境;不同野鳥是否會進到家禽場吃家禽的飼料,吃飼料的喜好也不同。
目前仍需要更科學性地了解這些複雜因素之間的交互作用,尤其是針對野鳥與家禽棲地重疊的地方,必須加強監測與阻止病毒在家禽與野鳥間傳播,才可能防堵病毒的持續演化,並避免造成感染人類的大流行。