- 封面故事
- 2024年
- 659期 - 外泌體到底是什麼?(11月號)
文章專區
2024-11-07如何生產外泌體? 細胞外囊泡的生產與應用
659 期
Author 作者
江佩馨 | 工業技術研究院生醫與醫材研究所資深研究員、精準診斷與創新醫療技術組副組長。
Take Home Message
• 細胞外囊泡如同細胞間的快遞,能攜帶蛋白質、核酸等重要分子,並在細胞間傳遞訊息。依大小可分為外泌體、微囊泡、凋亡小體三類。
• 細胞外囊泡的生產涉及細胞培養、分離與純化等關鍵步驟,需要特殊的生物反應器、層析技術等設備,並進行嚴格的品質管控。
• 細胞外囊泡的大規模生產是一項必須解決的難題,像是如何提高細胞外囊泡的產量、純度;生產過程中的一致性和重複性也至關重要。
想像一下,我們體內的細胞就像一座座微型工廠,不僅需要自我運作還需要彼此交流,以維持整身體的正常運作。而細胞外囊泡(extracellular vesicles, EVs)就是這些微型工廠用來傳遞訊息的小型「快遞包裹」。這些微小的囊泡被包裹在脂質雙層膜中,攜帶著蛋白質、核酸(例如mRNA、microRNA)及脂質等重要分子,可以在細胞間移動,並將重要資訊傳遞到不同的細胞中。
近年來,科學家發現這些細胞外囊泡在醫學和生物科技領域中應用深具潛力,無論是作為疾病診斷工具,或是用於精準藥物傳輸,細胞外囊泡都顯示出無限可能。本文將帶領讀者深入了解這些神奇囊泡的生產製程,以及它們在醫療產業中的應用。
細胞外囊泡的種類與功能
細胞外囊泡可以根據大小和來源的不同,區分為三大類:
● 外泌體(exosome):直徑約為30 ~ 150 奈米(nm),它的來源為胞內體(endosome),並經由細胞內的吞噬體(phagosome)釋放到外部。
● 微囊泡(microvesicle):直徑約在100 ~ 1000 nm 之間,來源於細胞膜直接向外擴展過程。
● 凋亡小體(apoptotic body):細胞在凋亡(apoptosis),或是稱程序性死亡(programmed cell death)過程中產生的較大囊泡,直徑通常為50 ~ 5000 nm。
這些囊泡承載著來自母細胞的訊息,能夠影響目標細胞的行為。例如外泌體可以將mRNA 轉移到另一個細胞中,此過程可能會改變接收細胞的蛋白質表現進而調節細胞的不同功能。因此,細胞外囊泡在細胞之間的訊息傳遞中有著重要功能與作用。
如何生產細胞外囊泡?
隨著相關研究愈加深入,細胞外囊泡已逐漸應用於治療和診斷的相關研究。然而,細胞外囊泡的生產過程充滿挑戰,為了確保產生出的細胞外囊泡具有高品質和高純度,需要有效的生產策略。以下是生產細胞外囊泡的關鍵步驟,包括細胞培養、分離與純化技術。
細胞培養與細胞外囊泡釋放
細胞外囊泡的生產始於細胞培養。在臨床和研究應用中,常使用間質幹細胞(mesenchymal stemcell, MSC)和人類胚胎腎細胞(human embryonic kidney cells 293, HEK293)等細胞株,這些細胞能夠在生物反應器中進行大規模的培養,並分泌大量細胞外囊泡。不過有些應用也會使用自然界來源的細胞外囊泡,例如牛奶、藻類或植物都存在細胞外囊泡。
細胞外囊泡的大規模培養最常使用批次培養和連續式培養技術。在批次培養中,研究者會在生物反應器內添加營養物質以維持細胞的生長,而連續式培養則透過不斷地添加和排出培養基來提高產量。生物反應器能夠精確控制培養環境,像是氧氣濃度、pH 值、溫度等參數,以確保細胞保持最佳狀態並最大化細胞外囊泡的釋放。
此外,有些物理刺激技術,例如機械力、電場、磁場等,也被用於促進細胞分泌更多的細胞外囊泡。舉例來說,機械剪切力能有效促進細胞間通訊、進而增強細胞外囊泡的釋放;基因工程技術可用於改造細胞,使細胞產生攜帶特定訊息的細胞外囊泡,而這些細胞外囊泡可用於更精準的治療應用。
細胞外囊泡的分離與純化
從細胞培養基中分離出高純度的細胞外囊泡,是生產過程中的關鍵步驟,主要考量分離純化後細胞外囊泡的純度、回收率、完整性、通量、規模化。傳統的分離方法包括超速離心技術,該技術基於顆粒大小和密度的不同,能夠有效地將細胞外囊泡與其他較大的細胞碎片分離。然而,這種方法耗時且難以大規模應用。另外利用高分子聚合物,例如聚乙二醇(polyethylene glycol, PEG)沉澱法,通過減少水分子與細胞外囊泡間相互作用,使細胞外囊泡聚集並沉澱,相對簡單且成本低,常用於實驗室中進行初步分離。但可能共沉澱蛋白質或核酸等汙染物,純度低且分離時間較長,可能需要後續純化步驟,像是超速離心或層析法來提高分離效果。
在細胞外囊泡的大規模生產中,層析技術是一種常用的分離方法,特別是尺寸排阻層析(size exclusion chromatography, SEC)和離子交換層析(ion exchange chromatography, IEX)。尺寸排阻層析依照細胞外囊泡的大小進行分離,而離子交換層析則利用細胞外囊泡表面電荷的差異來去除蛋白質和核酸等雜質,層析技術能夠移除超過80%的蛋白質雜質,並確保細胞外囊泡的高純度與高回收率。
此外,像是滲透膜過濾技術(microfiltration)和切向流過濾(tangential flow filtration, TFF)等過濾法,以及免疫親和捕捉(immunoaffinity capture)技術也被應用於細胞外囊泡的純化。過濾法的原理是透過分子量篩選,可有效去除較大或較小的雜質;而免疫親和捕捉技術則使用抗體標靶細胞外囊泡表面標記,實現高純度分離。非對稱流場分離法技術(asymmetric flow field-flow fractionation, AF4)同樣應用於細胞外囊泡分離,利用流體動力學大小來分離顆粒。樣本於薄而平坦通道中流動,透過通道底部半透膜垂直交叉流共同作用,使得不同大小的顆粒在不同流速下分離,能快速有效分離不同尺寸細胞外囊泡,但需專業操作且過程複雜,設備成本相對高(圖一)。
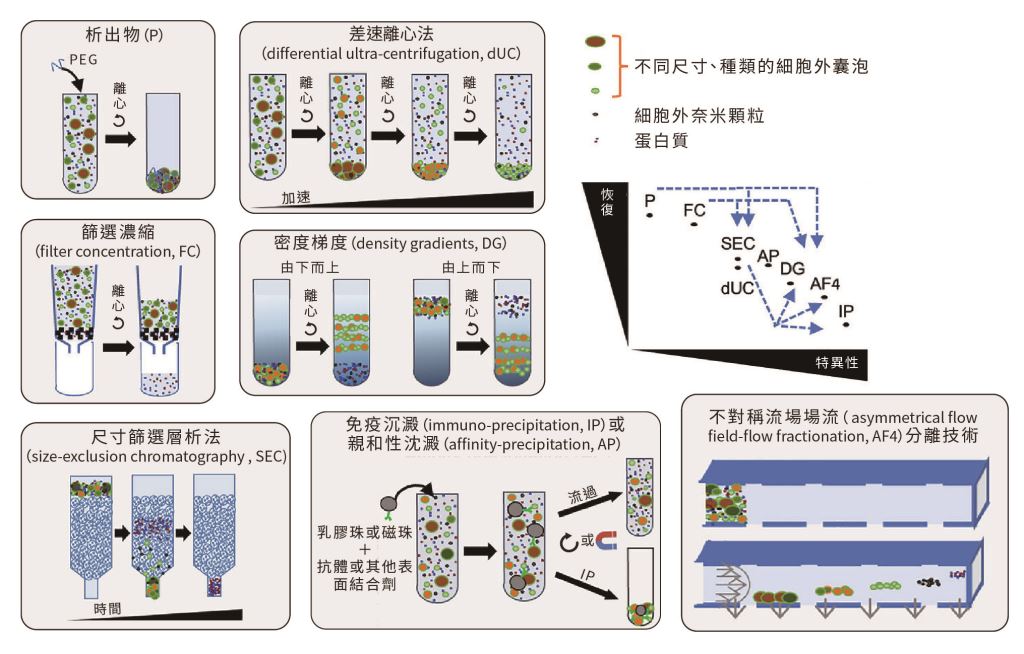
圖一|細胞外囊泡分離純化技術在回收率與特異性比較
(延伸閱讀3)
……【更多內容請閱讀科學月刊第659期】