- 封面故事
- 2024年
- 659期 - 外泌體到底是什麼?(11月號)
文章專區
2024-11-07開創再生醫療新紀元? 外泌體的再生醫學應用
659 期
Author 作者
廖秀蓉 | 亞東紀念醫學研究部研究員,陽明交通大學生物藥學所兼任助理教授。
Take Home Message
• 外泌體是一種由細胞分泌的微小囊泡,作為細胞間訊號傳遞的媒介,調控細胞的行為和功能。
• 外泌體在幹細胞療法和再生醫學領域具有重要應用潛力,可用於組織修復、免疫調節、疾病診斷、治療退化性關節炎等與老化相關的疾病。
• 外泌體在發展臨床應用時將面臨製備與保存的技術挑戰,包括分離純化、品質控管、儲存條件等。
2018 年,臺灣通過修訂的《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》(簡稱特管辦法),促進了再生醫療領域的蓬勃發展。不僅限於細胞治療,其他的細胞衍生物,例如胞外體(extracellular vesicles, EVs,又稱細胞外囊泡)也逐漸被應用於受損組織修復、免疫微環境調節、疾病診斷,以及作為替代現有藥物反應不足的另一種選擇。
EVs 的特性通常取決於它的細胞來源。以間質幹細胞(mesenchymal stem cell)為例,因為它具有顯著的組織再生功能,由它衍生的EVs 可被用於治療年齡增長或膝關節過度使用所導致的退化性關節炎。此外,罹癌病患癌細胞所分泌的EVs 在全身性血液循環中也能作為特定癌細胞的生物標誌,作為癌症的診斷。因此,EVs 的應用範圍廣泛,具有極大的開發價值。
什麼是胞外體和外泌體?
根據今(2024)年國際胞外體學會(International Society for Extracellular Vesicles, ISEV)發表於《外泌體期刊》(Journal of Extracellular Vesicles)的論文,EVs 被定義為「由細胞自然釋放,無法自行複製且不含細胞核的雙層脂質結構顆粒」(延伸閱讀1)。EVs 因生成機制和來源細胞的差異而具有異質性,這些差異通常表現在顆粒大小和內部訊息因子的多樣性上。
而本文的主角――外泌體(exosome),是EVs 的一種,大小約為30 ~ 150 奈米(nm),具有雙層脂質膜,內含核酸、蛋白質、醣類、脂質等多種訊號分子。外泌體內的分子可以作為細胞間訊號傳遞的媒介,進而調控細胞的行為和功能。幾乎所有細胞都會分泌外泌體,因此常被用作細胞衍生的胞外體的概稱(圖一)。
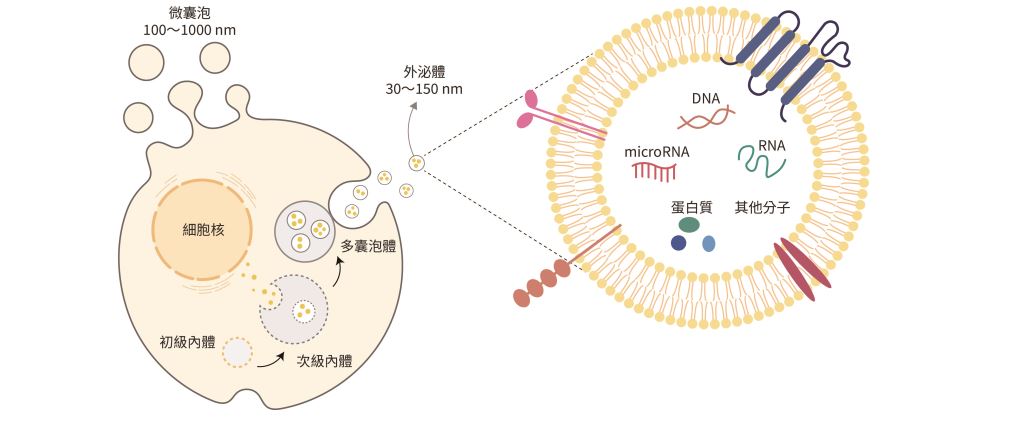
圖一|外泌體的大小及特徵。外泌體可攜帶多種生物物質作為載體,並應用於疾病治療。
(資料來源:作者提供)
外泌體治療的優點
基於不同細胞的特性,外泌體在臨床應用中日益受到關注,包含再生醫療、精準醫療、預測診斷等。此外,過去在治療寵物和賽馬的退化性關節炎中,主要會依賴藥物和細胞治療,近年來外泌體療法則逐漸成為這些領域的新興趨勢。
對於某些受疾病所苦的患者,細胞治療也為他們提供了另一種治療選擇。尤其在衛生福利部發布特管辦法後,開放自體CD34+ selection 周邊血幹細胞(peripheral blood CD34+ cells)、自體免疫細胞(immune cell)、自體脂肪幹細胞(adiposederived mesenchymal stem cell)、自體骨髓間質幹細胞(bone marrow-derived mesenchymal stem cell)、自體纖維母細胞(fibroblast)、自體軟骨細胞(chondrocyte)等六類細胞治療技術可於國內核准的醫療機構中實施,並強調以自體細胞進行治療(延伸閱讀2)。
然而,當患者身體狀況不佳、只能使用異體細胞或功能性佳的超級捐贈者細胞(super donor)來源時,就必須等待臨床試驗通過才能夠使用異體細胞。異體細胞治療的價格比衍生物胞外體或外泌體療法更高加昂貴,且由於個體細胞的異質性,可能導致治療效果的差異甚大。此外,宿主(患者)在接受細胞治療後,這些細胞在體內是否會分化成癌細胞,仍是需要持續討論的議題。
然而,當患者身體狀況不佳、只能使用異體細胞或功能性佳的超級捐贈者細胞(super donor)來源時,就必須等待臨床試驗通過才能夠使用異體細胞。異體細胞治療的價格比衍生物胞外體或外泌體療法更高加昂貴,且由於個體細胞的異質性,可能導致治療效果的差異甚大。此外,宿主(患者)在接受細胞治療後,這些細胞在體內是否會分化成癌細胞,仍是需要持續討論的議題。
非細胞治療目前主要以細胞衍生物――外泌體作為治療來源。由於外泌體的生物特性,它能留存在患者體內的時間有限,安全性相對較高。外泌體作為細胞分泌的囊泡,也具備原始細胞特質,因此不僅具有治療的安全性,且仍保有原始細胞的治療功能。再加上外泌體大量生產的成本相對低,使近年來外泌體的相關新興產業興起,例如改善神經退化性疾病、皮膚老化、落髮等症狀。
外泌體治療面臨困境與挑戰
在臺灣,因應特管辦法,患者可在醫療院所接受自體細胞治療。隨著立法院於今年6 月4 日三讀通過《再生醫療法》及《再生醫療製劑條例》(合稱《再生醫療雙法》),民眾對於異體細胞來源的細胞治療有更深入的了解。異體細胞及外泌體的使用,必須透過臨床試驗證明它們的安全性與有效性後,才能被應用於治療。
然而,外泌體的應用與藥物規範有著本質上的不同。外泌體源自細胞,無論是幹細胞或免疫細胞,它們衍生的外泌體在純化後作為藥物開發仍面臨諸多挑戰,包括細胞的高度異質性,以及每次純化批次之間顆粒性、濃度、有效成分表現量的差異性。目前在批次穩定性方面,我們可使用小RNA(microRNA)作為外泌體純化的一項重要指標。microRNA 是外泌體的主要內容物之一,能調控多種生物的基因表現,且常被視為具有治療潛力的關鍵成分。
外泌體純化和檢測方法的改進也是研究人員不斷追求的目標。超過濾法(ultrafiltration, UF)是胞外體純化技術中常使用的方法,其中又以切向流過濾(tangential flow filtration, TFF)較適合作為大體積(> 500 毫升)純化的工具。然而市面上有多種廠商與品牌,因此在純化外泌體的步驟上存在技術差異,但外泌體純度又會與操作流程的設計及執行參數的調整有關。綜合以上種種因素,外泌體在產業化量產上面臨相當大的挑戰(圖二)。
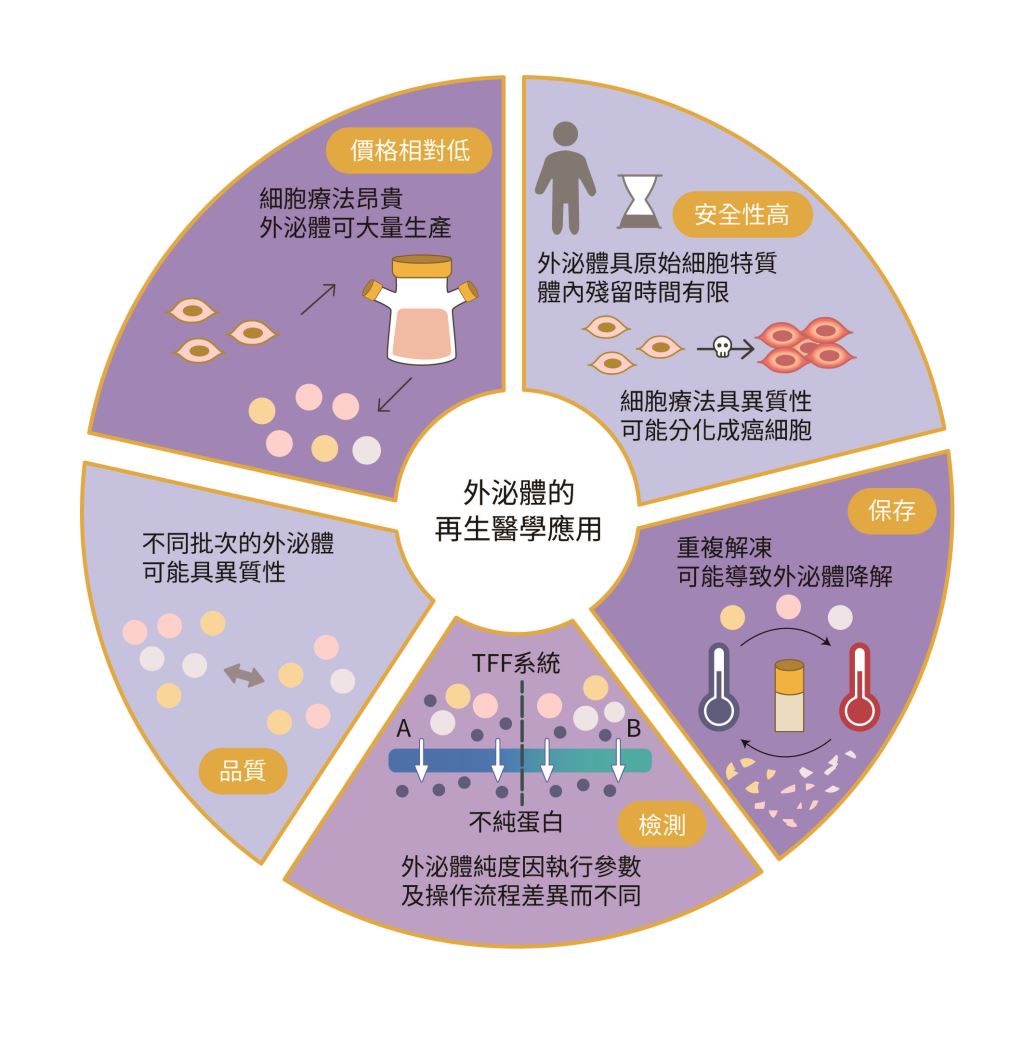
圖二|胞外體在再生醫療產業的優缺點(劉與佳繪製;資料來源:作者提供)
而在以外泌體進行非細胞治療的研究中,通常會選擇增殖能力強,且不因細胞數目擴大過程而顯著改變行為和活性的細胞來源。其中最常用於再生醫療領域的是間質幹細胞,但仍有擴增代數的限制性。雖然在免疫治療策略中,免疫細胞也是常見的研究對象,但由於免疫細胞的擴增難度較高,且可能需要收集大量宿主組織或血液來培養足夠的免疫細胞,才能獲得足夠的外泌體,這對於大量生產來說相當具有挑戰性。儘管有些實驗室會使用免疫細胞株(cell line)來生產外泌體,但值得注意的是,所使用的免疫細胞株是否符合各國法規,仍需進一步討論。
此外,外泌體的「保存」也是一項重大挑戰。即使以低溫(-80℃、-20℃、4℃)保存,在單次解凍,外泌體仍可能會降解或團塊化。如果反覆解凍後,更容易導致外泌體結構的不穩定性,並大幅降低具效療效的外泌體數量。為了減少外泌體的降解,常會使用玻尿酸等聚合物來包覆外泌體,這不僅能減緩降解,還能逐漸釋放外泌體。此外,冷凍乾燥技術也是常見的外泌體保存方法之一。因此,選擇適當的聚合物將成為保存外泌體的新興研究領域之一。
不可忽視的外泌體市場
隨著再生醫療領域的迅速發展,外泌體市場已成為各大醫療院所不可忽視的治療選擇。然而,選擇適當的細胞來源、純化方法、確保外泌體品質及保存方式,都是開發外泌體產品的關鍵課題。因此,通過產官學研合作,結合國家醫療法規,為患者提供一種既安全又有效的治療選擇,將成為新世紀的重要突破。這種協作不僅有助於推動再生醫療的進一步發展,也將提高病患的治療效果和生活品質。
延伸閱讀
1. Welsh, J. A., et al. (2024). Minimal information for studies of extracellular vesicles (MISEV2023): from basic to advanced approaches. Journal of Extracellular Vesicles, 13, e12404.
2. 衛生福利部,細胞治療技術資訊專區,https://celltherapy.mohw.gov.tw/。