- 封面故事
- 2024年
- 659期 - 外泌體到底是什麼?(11月號)
文章專區
2024-11-07從沒沒無聞到聲名大噪 外泌體的發現、命名與發展
659 期
Author 作者
黃奇英 | 國立陽明交通大學藥物科學院特聘教授兼副院長,研究領域包括老藥新用、外泌體在疾病檢測與治療等領域。鄭大山 | 博士後研究員,專注於外泌體在疾病檢測與治療等領域的研究。
Take Home Message
• 細胞外囊泡是細胞分泌出的奈米級顆粒,在細胞間中扮演傳遞訊息的角色。細胞外囊泡種類多樣,其中又以外泌體最受關注。
• 外泌體過往被視為細胞的廢物處理機制,現在則被認為具有重要的生物學功能,在疾病診斷、疾病治療、再生醫學和生物標記方面有巨大潛力。
• 雖在疾病診斷和治療展現多樣的可能性,但外泌體的臨床應用仍面臨製備、品質控制等挑戰。
細胞外囊泡(extracellular vesicles, EVs,又稱胞外體)是由細胞分泌、具有脂質雙層結構的小顆粒,內含蛋白質、核酸、代謝物等各種物質,在細胞間訊息傳遞中扮演重要角色。細胞外囊泡種類多樣化,主要包括外泌體(exosome)、微囊泡(microvesicle, MV)和凋亡小體(apoptotic body)(圖一)。
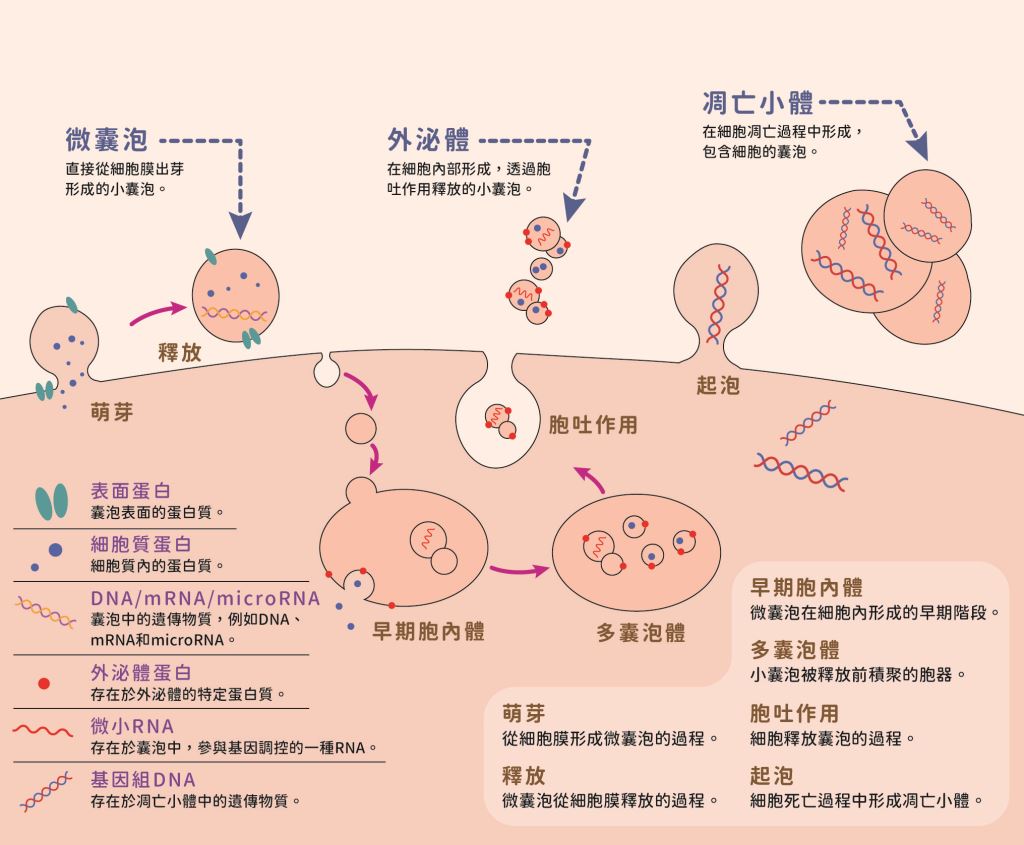
圖一|微囊泡、外泌體、凋亡小體的形成機制示意圖
(資料來源:延伸閱讀1)
對於科學家來說,最引人注目的就是外泌體。外泌體能透過多泡體(multivesicular bodies, MVBs)與細胞膜融合並釋放,直徑約為30 ~ 150 奈米(nm),因此目前相關領域的學者也將它稱為小型細胞外囊泡(small EVs, sEVs)。另外,微囊泡直徑範圍則為100 ~ 1000 nm,由細胞膜外突所產生。凋亡小體直徑範圍為 50 ~ 5000 nm,由經歷細胞凋亡(apoptosis,又稱程序性細胞死亡)的細胞產生。
外泌體的命名和研究歷程
命名問題起初在這個領域備受挑戰,雖然現在「細胞外囊泡」已被普遍接受,但「外泌體」這個術語已深深嵌入科學界的詞彙中。1981 年,由美國國家神經與溝通障礙與中風研究所(National Institute of Neurological and Communicative Disorders and Stroke, NINCDS)博士特拉姆斯(Eberhard Trams)領導的研究團隊首次使用「外泌體」一詞,描述細胞表面釋放的細胞外囊泡。他們將從培養細胞中分離的囊泡稱為「外泌體」,「外泌」(exo)代表它們是向外排出,並且存在於細胞外;「體」(some)則表示它們通過高速離心分離,類似於當時已知的「微粒體」(microsome)和「突觸體」(synaptosome)。不過,當時的研究人員主要將外泌體視為細胞「廢物處理機制」。 在約翰斯通(Rose Johnstone)1991 年的論文中,則是將外泌體描述為「淘汰過時膜蛋白的主要途徑」,這一觀點在隨後十年間對EVs 的研究方向產生了深遠影響。
外泌體的來源是胞內體(endosome)。首先,細胞內膜向內產生早期胞內體(early endosome),這些胞內體透過融合進入下一步的分選過程,決定它們最終的生物代謝路徑。早期胞內體可以與內吞小泡融合,引導其中攜帶的物質進行再循環、降解或分泌。如果物質被回收,它們將形成再循環胞內體;而其餘的早期胞內體則成熟為晚期胞內體。晚期胞內體的膜向內形成MVBs,其中包含大量的內腔小泡(intraluminal vesicles, ILVs)。在此階段,MVBs 同樣可以與溶酶體(lysosome)融合,進一步降解ILVs;或與細胞膜融合,將ILVs 釋放至細胞外環境。這些釋放出的ILVs 就是外泌體,含有細胞內的多種蛋白質、核酸、脂質和多醣。另一種EVs 的釋放機制是細胞膜向外突出,形成釋放性的微囊泡。
隨著外泌體的發展,科學家開始研究在疾病狀態下EVs數量的變化,並探索物理和生化特性,也引起了研究人員對EVs在生物學功能中潛在作用的關注(圖二)。此類研究開啟了EVs作為疾病治療和生物標記的應用前景,並為21 世紀初EVs研究的爆發提供了動力。
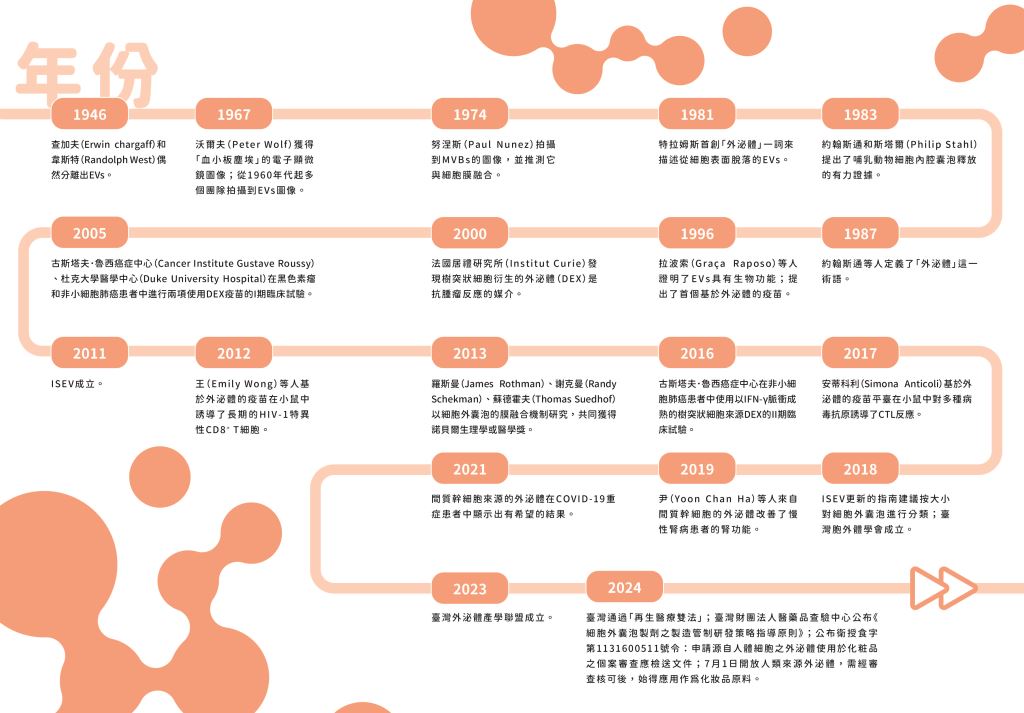
圖二| EVs 發現、研究及應用的關鍵事件
2011 年,科學家在法國巴黎舉辦的國際會議上成立了國際細胞外囊泡學會(International Society for Extracellular Vesicles, ISEV),也同時促進了EVs 研究的發展。ISEV 積極地提供教育資源及標準化指南, 例如2014 年、2018 年、2023 年的MISEV 指南(延伸閱讀2),並組織各種專題研討會,推動了EVs 領域的學術發展。臺灣為了可以在地深耕並與國際連結,於2018 年成立「臺灣胞外體學會」,並致力於協助外泌體研究及學術研究的開發。緊接著於去(2023)年成立「臺灣外泌體產學聯盟」,橋接產業與學術,以提升開發外泌體應用的前景。
然而,外泌體生物學領域仍有許多未知之處,例如缺乏適當的標誌物來鑑別不同類型的EVs 及外泌體。研究顯示,EVs 的不同亞型在攜帶物質、釋放機制和功能上均不相同,深入地研究這些亞型EVs,將有助於進一步理解EVs 的多樣性和作用機制。此外,EVs 如何將載荷物質有效傳遞至受體細胞,再轉換成訊息,仍有待進一步探索。
EVs 研究的發展同時也面臨了諸多挑戰,包括實驗可重複性和命名標準的問題。不同實驗室之間對於EVs 或外泌體的生物富集(enrichment)和分離方法並無統一共識,且存在超過100 種不同的分離方法。另外,由於缺乏標準化和詳細的實驗報告,使得結果的比較和解釋相對變得困難。在技術上,由於外泌體的體積小、來源複雜,使得純化分離、表徵鑑定、定量都有一定的難度。因此,還需要更高效的單一囊泡技術、更精確的在活體內檢測,以及證實這些技術效果的研究方法。
外泌體的臨床應用潛力
目前已有研究顯示,間質幹細胞(mesenchymal stem cell, MSC)可透過釋放營養因子、旁分泌因子、粒線體轉移、分泌EVs(特別是外泌體)來達到再生或治療的效果。雖然間質幹細胞治療為一些難治性疾病帶來的希望,例如脊髓損傷、急性呼吸窘迫症候群(acute respiratory distress syndrome, ARDS)、心肌梗塞等疾病,但卻因原有的特質侷限性,例如免疫原性、潛在致瘤性等,使得部分試驗未能成功。外泌體作為細胞間的訊息傳遞者,廣泛存在於血液、尿液、腦脊髓液等體液中,因此臨床研究正積極地探索外泌體在癌症、神經退行性疾病、心血管疾病、關節炎等領域的應用。
由於外泌體具有多重功能因此具有優越的治療潛力, 它能有效地攜帶核酸、蛋白質等藥物進行標靶治療, 並能夠穿越血腦屏障(blood brain barrier)。外泌體作為自然存在的奈米載體,優勢在於免疫原性低、滲透能力強,成為基因和藥物傳遞的理想候選者(圖三)。
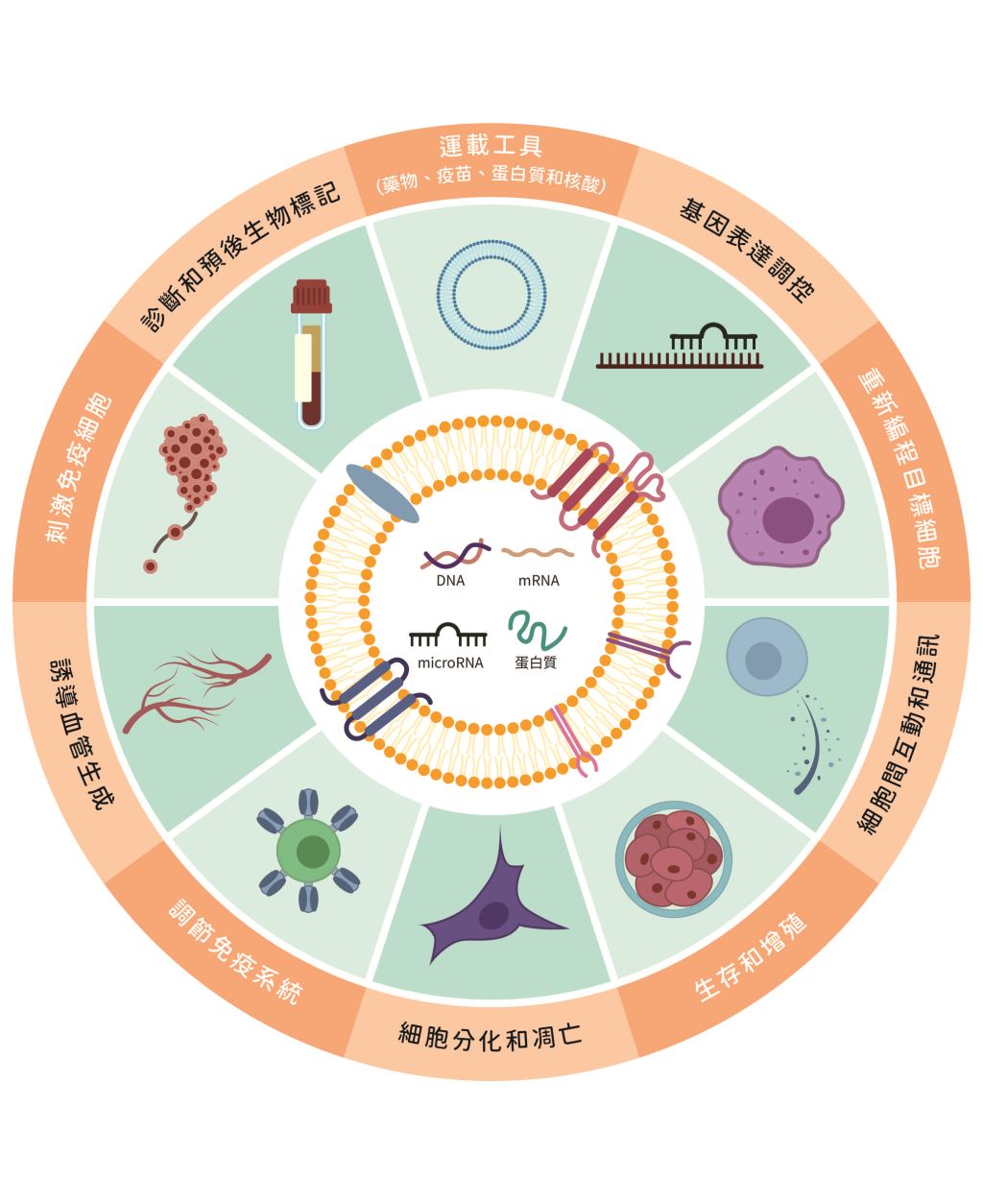
圖三|外泌體標記的應用(資料來源:延伸閱讀3)
總合以上,由於外泌體可作為一種具有前景的藥物遞送載體,正愈來愈備受關注。許多研究人員正在積極地探索不同的實驗方法令外泌體能攜帶治療分子,包括兩種策略:一、外源性,先分離出外泌體再進行載入;二、內源性,針對來源母細胞進行修飾或刺激。儘管在分離和攜帶效率方面存在挑戰,但外泌體作為標靶藥物遞送的潛力,已讓它成為未來研究和臨床應用中令人興奮的新方向。
外泌體在多種疾病的診斷和治療中展現出巨大的效能。在退化性骨關節炎中,間質幹細胞衍生的外泌體可促進軟骨再生,抑制發炎和細胞凋亡。對於神經退行性疾病,例如阿茲海默症(Alzheimer's disease)和多發性硬化症(multiple sclerosis),外泌體能穿越血腦屏障,攜帶治療性分子以減少病理蛋白的累積,調節免疫反應並促進神經修復。在心血管疾病中,外泌體可以作為生物標記(biomaker)預測疾病風險,並參與心臟修復、血管生成和抗纖維化過程。在癌症領域,外泌體可影響腫瘤微環境,促進或抑制腫瘤進展,也可作為診斷標記和藥物遞送載體。於肺部損傷,特別是急性肺損傷和新冠併發重症(COVID-19)引起的損傷中,外泌體具有抗發炎、抗纖維化、促進組織修復的作用。在罕見疾病中,例如神經系統疾病雷特氏症候群(Rett syndrome)和溶小體儲積症法布瑞氏症(Fabry disease),外泌體則提供了新的診斷和治療策略。因此,外泌體獨特的生物學特性,為多種疾病的治療帶來了新的希望。
疾病治療新希望?
外泌體奈米級大小和天然的生物相容性,使它能夠穿透生物屏障,在體內快速分布,成為理想的藥物和治療性核酸運輸工具,因此在許多疾病的治療上展現出巨大潛力。雖然目前仍處於研究階段,但它作為診斷和治療載體的潛力,為現行無有效療法及罕見疾病的患者帶來了新希望。
然而,儘管外泌體在這些領域占有一席之地,在臨床應用上仍面臨一些挑戰,例如大規模製備、品質控制、安全性評估,以及適當劑量及最佳給藥途徑等問題,期待未來的研究者進一步找出解決之道。
延伸閱讀
1. Lawson, C., et al. (2016). Microvesicles and exosomes: new players in metabolic and cardiovascular disease. Journal of Endocrinology, 228(2), R57– 71.
2. Welsh, J. A., et al. (2024). Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. Journal of extracellular vesicles, 13(2), e12404.
3. Dilsiz, N. (2022). Hallmarks of exosomes.Future Science OA, 8(1), FSO764.