- 封面故事
- 2024年
- 659期 - 外泌體到底是什麼?(11月號)
文章專區
2024-11-07神奇的細胞「快遞員」 揭開外泌體的功能與應用
659 期
Author 作者
沈湯龍 | 任職於臺大植微系,研究領域有癌症生物學、外泌體、類病毒及微生物應用。
Take Home Message
• 外泌體是細胞分泌的小囊泡,在細胞間扮演「快遞員」傳遞訊息分子,在生理病理過程發揮重要作用。
• 外泌體因生物相容性與標靶能力,能穿越血腦屏障,被視為潛在藥物載體,在癌症和神經疾病治療有巨大潛力。
• 外泌體作為液態檢體,在疾病早期診斷和再生醫療領域展現巨大潛力,為臨床診斷和治療開闢了新的方向。
在身體內的細胞世界中,存在著一種微小但豐富的「快遞員」――外泌體(exosome)。這些直徑僅有30 ~ 150 奈米(nm)的小囊泡,扮演著細胞之間溝通的重任。儘管體積微乎其微,外泌體卻在調節生理和病理發生、進展過程等方面發揮著關鍵作用。那麼,什麼是外泌體?它們如何影響我們的健康與疾病?讓我們一同揭開外泌體的神祕面紗,探索它在細胞間通訊和疾病發展中的重要角色。
遍布全身的外泌體
目前已知人體內幾乎所有類型的細胞都會分泌外泌體。它們起源於細胞透過胞吞作用(endocytosis)形成的胞內體(endosome),以及後續的胞內體內吞(invagination)在細胞內部所生成的多囊泡體(multivesicular bodies, MVBs)。當MVBs 與細胞膜融合時,外泌體便被釋放到細胞外。細胞可以利用外泌體傳遞蛋白質、核酸、脂質、代謝物等生物分子,作為細胞之間的訊息交流模式。因此,外泌體也被視為細胞之間的快遞員。
在正常生理過程中,外泌體可參與免疫調節、神經傳導、組織再生修復等多方面功能。相對地,外泌體也在某些病理過程中扮演著不容忽視的角色。隨著研究不斷深入,我們對外泌體扮演的角色功能也愈來愈清晰。這些微小的快遞員,甚至提供了細胞間長距離交互作用的重要管道。然而,外泌體並非一開始就為人所知,它們的發現過程充滿了偶然與驚喜。為了更深入了解外泌體的起源和功能,讓我們回到20 世紀、1980 年代初的實驗,追溯外泌體被首次發現的故事。
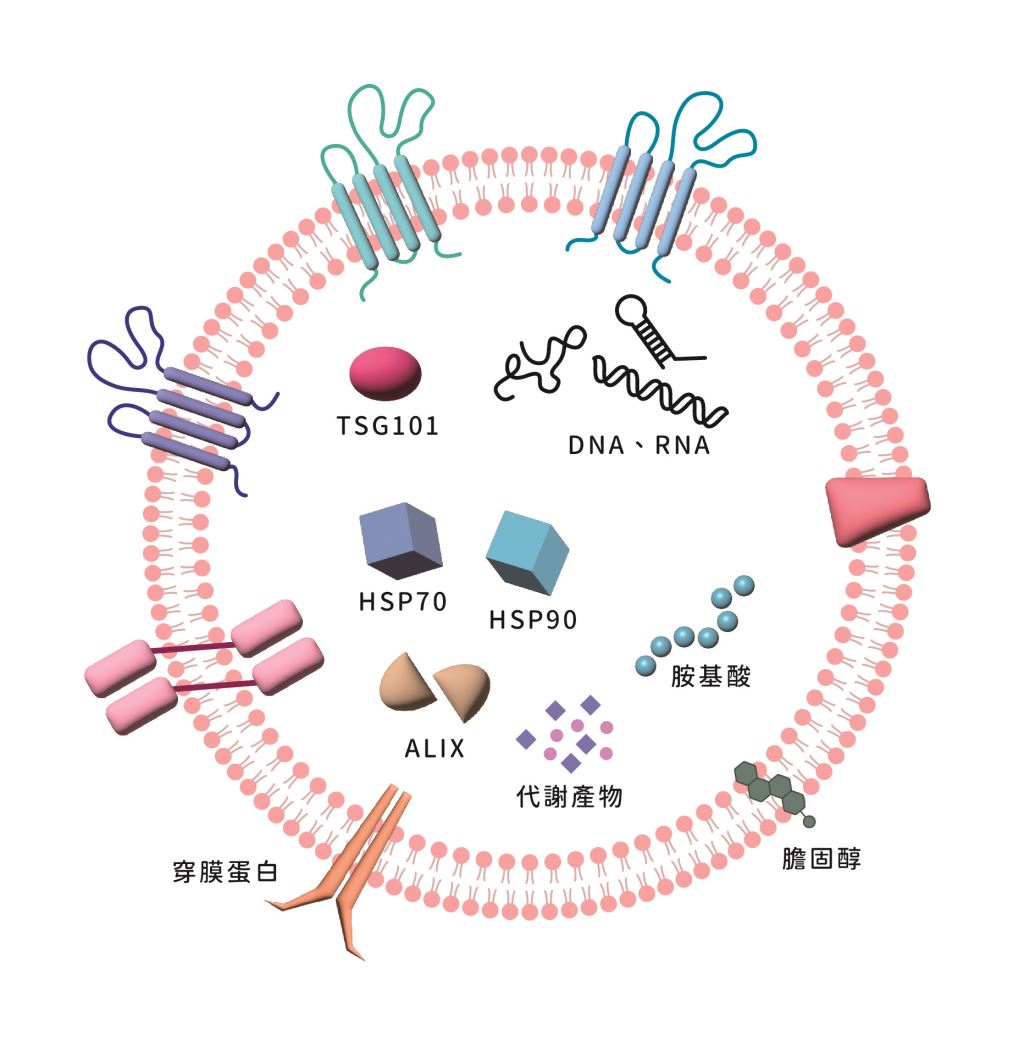
▲外泌體的特徵與功能
外泌體是由所有細胞生成的細胞外囊泡,內含核酸(DNA 和RNA)、蛋白質、脂質、代謝物等。它們在細胞間短距離和長距離的通訊中扮演著重要角色,並對細胞生物學的多個方面產生影響。(資料來源:延伸閱讀1)
序曲-外泌體的發現與真實身分
1983 年,美國醫學博士哈丁(Clifford Harding)等人首次觀察到多囊泡胞內體(multivesicular endocytic compartments)中存在的微小囊泡分泌現象;這一發現隨後在1985 年由潘(Bin-Tao Pan)等人進一步確認。這些多囊泡胞內體在與細胞膜融合後,便會釋放到細胞外形成外泌體。起初,這些囊泡並未引起科學家的注意,被認為只是細胞丟棄細胞內廢棄物的「垃圾袋」。
1987 年,約翰斯通(Rose Johnstone)等人正式將這些細胞所分泌的小囊泡命名為「外泌體」(延伸閱讀2)。然而,1990 年代開始的許多研究意外地發現外泌體並非只是細胞的垃圾袋,同時也是攜帶著重要活性生物分子的「快遞員」。更令人興奮的是,蛋白質組學和核酸定序技術揭示了外泌體內部豐富的「貨物」――活性脂質、蛋白質酵素、轉錄因子、受體、代謝化合物和各種核酸,特別是微小RNA(microRNA)。原來,外泌體就像一個微型的「訊息包裹」,攜帶著細胞間交流所需的關鍵訊息分子。
木馬屠城-外泌體作為藥物遞送的載體
由於外泌體可以在細胞間精準地傳遞生物分子,科學家便開始思考藥物是否也能利用外泌體進行精準、有效的傳遞?由於外泌體的表面組成如同細胞膜且皆為雙層磷脂質(phospholipid-bilayer),因此可保護被遞送的藥物,有助於進行長距離的傳遞,且在到達目標組織細胞時因具生物相容性而易被吸收。另一方面,奈米級大小和表面的多種受體,也提供了外泌體高度的組織滲透性及專一性標靶能力。
外泌體就像是專屬快遞員,科學家認為它能將藥物精確有效地遞送到特定的細胞,特別是在癌症治療中。例如源自癌細胞的外泌體,若可以攜帶化療藥物、促進標靶遞送,便可能克服癌細胞的耐藥機制。這種標靶方法對於將外泌體應用於癌症治療上具有新的潛力,也突顯了它們在改善癌症治療的研究和臨床試驗中的吸引力。
更令人驚奇的是,外泌體具有穿越生物屏障的能力,例如血腦屏障(blood-brain barrier)。血腦屏障就像一道嚴密的城牆,保護著我們的腦部不受外界物質侵害,然而這也為藥物遞送帶來了挑戰。外泌體內含「貨物」的多樣性就像一把 「萬能鑰匙串」,能夠穿越這道城牆、將藥物送入大腦。這一特性在治療神經系統疾病方面尤為寶貴,因為傳統的藥物遞送方法可能會失敗。事實上,外泌體還可透過遺傳工程來增強標靶能力,允許特定的藥劑直接遞送到病變的組織或器官,為阿茲海默症(Alzheimer's disease)、腦腫瘤等神經系統疾病帶來新希望。
敵人或朋友? 外泌體在疾病中的角色與應用
不同組織器官間的功能平衡對於健康十分重要,而外泌體在組織細胞間的聯繫與溝通在人體內扮演著多重角色。不僅是正常的生理過程,甚至在疾病的發展病程中,外泌體都發揮著重要作用。2007 年,瑞典癌症專家瓦拉迪(Hadi Valadi)等人的研究團隊發現腫瘤細胞會釋放大量的外泌體(延伸閱讀3)。這些外泌體不僅攜帶著促進腫瘤生長和轉移的生物分子,還影響腫瘤周圍正常細胞的基因表現和行為。就像腫瘤細胞派出的「間諜」,在體內散播不利於健康的訊息,成為腫瘤的幫凶,促進腫瘤細胞的進展,包含癌症的轉移。
同時,腫瘤外泌體還會干擾免疫系統的正常功能。它們能夠抑制免疫細胞的活性,使得免疫系統無法有效地識別和攻擊腫瘤細胞,導致「免疫逃逸」(immune evasion)的現象。這就好比腫瘤細胞給自己披上了「隱身衣」,逃避了身體的防禦。
儘管如此,科學家仍將目光投向外泌體,希望能夠借助它們特殊的運送能力將危機化為轉機,為醫學帶來新的突破。在癌症治療方面,如同前文所述,外泌體具備獨特的生物相容性、高組織滲透性、長距離遞送、異質生物分子保護和攜帶性等優勢,科學家甚至可對外泌體進行基因工程化改造,讓它們可發展成為抗癌藥物的「精準導彈」。
例如常用的化療藥物阿黴素(Doxorubicin),若封裝在外泌體內,便能夠直接將藥物送達腫瘤部位,減少對健康細胞的傷害,降低全身性的副作用。在免疫治療領域,外泌體同樣大放異彩。來自樹突細胞的外泌體能夠攜帶腫瘤抗原、活化T 細胞,並誘導強大的抗腫瘤免疫反應。這意味著我們可以利用外泌體調動免疫系統的力量,共同對抗癌細胞。
除了癌症,在心血管疾病的治療中,來自幹細胞的外泌體能攜帶有益於心臟健康的生物活性分子,能夠調節發炎反應,促進心肌細胞的修復,改善心臟功能。這為心肌梗塞、心力衰竭等疾病治療提供了新思路。
液態檢體-外泌體在疾病診斷中的潛力
外泌體在疾病的早期診斷和監測中同樣扮演著重要角色,這也是目前外泌體最被廣泛開發應用的方向。全世界至今有超過400 個外泌體的臨床試驗,其中一半以上都是針對外泌體作為疾病診斷的開發。由於能藉由它們攜帶的貨物內容物判斷分泌來源細胞的狀態,因此科學家開始嘗試將外泌體作為疾病的生物標記(biomarker)。相較於傳統侵入性組織檢體的切片染色,這種非侵入性的檢測方法被稱為「液態檢體」(liguid biopsy),為臨床診斷提供了快速、簡易、低風險、低成本新方法。由於外泌體幾乎是高含量的存在於所有體液中,而且隨著疾病進程發展,病變細胞所分泌的外泌體內容物也會隨之變化,內容物在外泌體囊泡內又具穩定性,因此相較於其他液態檢體內標的,例如循環腫瘤細胞 (circulating tumor cell, CTC)、循環腫瘤DNA(circulating tumor DNA, ctDNA) ,具有更大的發展應用潛力。
以「沉默的殺手」胰腺癌為例,因早期症狀不明顯且不易診斷,經常在晚期才被診斷出。而外泌體的出現,為我們帶來了新的希望。胰腺腫瘤在很早期即可釋放外泌體,且含有獨特的生物標記,包含蛋白質和RNA 分子。捕捉並分析這些「訊號」,有望實現胰腺癌的早期發現,為患者爭取寶貴的治療時間。
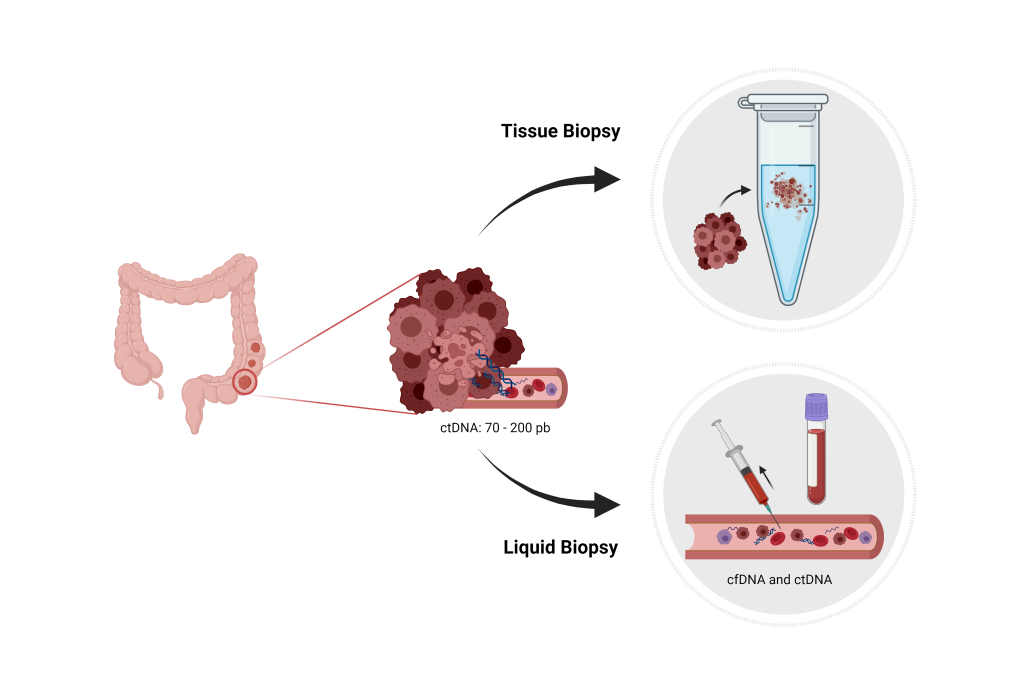 組織切片與液態檢體示意圖(Adobe Stock)
組織切片與液態檢體示意圖(Adobe Stock)
小兵立大功!外泌體在再生醫療的應用
近年來,幹細胞修復和再生的潛能已成為疾病和抗老化領域的熱門趨勢,且不論是在醫學研究或臨床案例中,皆引發關注。然而因幹細胞製備保存不易,還必須進行侵入性治療,又具有致癌風險和高成本。所以,近期得益於外泌體參與細胞間互相交流和傳遞重要的活性生物分子,利用幹細胞外泌體的再生醫療逐漸受到重視。
目前已有研究指出,來自間質幹細胞(mesenchymal stem cell, MSC)的外泌體,所攜帶著生物分子仍具有調節免疫反應、促進組織修復、減少發炎等功效,這讓它們在治療各種疾病時非常有價值。研究顯示,在肝臟受損的情況下,MSC 外泌體已被證明可以減輕由四氯化碳(CCl4)引起的肝損傷,發揮抗氧化作用,幫助組織修復和再生,成為肝病治療中的新希望。在神經保護方面,特別是在創傷性腦損傷和中風的情況下,它們能改善神經元的功能,減少受損區域的大小,顯示出它在治療神經系統疾病上的潛力。MSC 外泌體甚至還能增強調節性T 細胞的免疫抑制能力,幫助治療自身免疫疾病等過度炎症的狀況。
這些治療效果之所以能實現,是因為MSC 外泌體可以傳遞生物活性分子,影響基因表達和細胞行為。換句話說,它們可以調節與細胞死亡相關的蛋白質,增強細胞的存活能力、促進組織再生。
潘朵拉之盒 外泌體研究的挑戰與未來
然而,前路並非一片坦途。在探索外泌體的奧祕時,科學家也面臨諸多挑戰。首先,有效地從生物體液中取出外泌體,是一大難題。外泌體的體積微小、數量稀少,且與其他成分混雜,想要從不同物種,例如植物、微生物等,分離和純化出外泌體,猶如在大海中撈針。目前已研發出許多方法,包含差異性離心法(differential centrifugation)、沈澱法(precipitation)、親和性法(affinity)、色層管柱法(size-exclusive chromatography)、超過濾法(ultra-filtration)、微管道法(microfluidics)等,但我們仍需要開發更高效、經濟、複合的技術,來獲取高純度的外泌體。
其次,外泌體因異質性而難以統一描述和分析。每個外泌體都可能來自不同的細胞,攜帶不同的內容物,甚至許多外泌體仍攜帶細胞不要的廢棄物。目前仍有待建立標準化的分析方法,才能更準確地解讀外泌體傳遞的內容物和含量。
在使用外泌體作為藥物遞送載體時,我們也面臨著技術難題。如何提高外泌體的裝載效率、專一性和穩定性,確保它們能夠安全、有效地將藥物送達目標細胞,是目前尚未被解決的問題。此外,外泌體的免疫原性可能引發免疫反應,影響治療的安全性。未來若能深入研究外泌體與免疫系統的相互作用,開發降低免疫原性的方法,才可確保臨床應用的安全。
隨著外泌體療法的發展,法規和倫理問題也需要得到重視。目前,對於外泌體的臨床應用缺乏明確的監管指導,可能會限制它未來的發展。我們需要更完善的法規和倫理準則,確保研究和應用的合法合規。儘管挑戰重重,但科學家對外泌體研究的熱情絲毫未減。他們相信,隨著技術不斷進步,這些問題終將得到解決。
想像未來,我們能夠熟練地利用外泌體,開發出針對各種疾病的精準治療方法。外泌體將成為我們戰勝疾病的有力「盟友」,為人類健康帶來新的希望。讓我們期待這些細胞間的神祕快遞員揭開更多生命的奧祕,開創醫學的新紀元。
延伸閱讀
1. Kalluri, R., & LeBleu, V. S. (2020). The biology, function, and biomedical applications of exosomes. Science, 367(6478), eaau6977.
2. Johnstone, R. M., et al. (1987). Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). Journal of Biological Chemistry, 262(19), 9412–9420.
3. Valadi, H., et al. (2007). Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature cell biology, 9(6), 654–659.