- 封面故事
- 2020年
- 604期-冠狀病毒的迫降(4月號)
文章專區
2020-04-01病毒的自然宿主—蝙蝠
604 期
Author 作者
吳忠信/臺師大生命科學專業學院教授,曾任臺灣蝙蝠學會的理事長。
隱身洞穴的神祕物種
蝙蝠是地球上唯一真正可以飛行的哺乳動物,全世界的蝙蝠約有1000多種,僅次於囓齒目的動物種類,佔了哺乳類種類的四分之一。大翼手亞目(Pteropodidae)為體型較大的狐蝠,主要分布於熱帶及亞熱帶地區,牠們以森林為家,棲息時倒掛於枝幹上聚集成群,擁有靈敏的視覺與嗅覺。至於小翼手亞目(Microbat)的蝙蝠為體型較小的食蟲蝙蝠,為了捕食飛翔於空中的昆蟲,發展出特殊的回聲定位系統,全世界僅南北極與少數的海洋性島嶼沒有牠們的存在,天然或人工的洞穴、隧道、樹洞和葉叢,甚至是住家屋簷、屋縫和閣樓等建築物均為偏好的棲息處所(圖一)。
 圖一:蝙蝠在分類階層中屬於翼手目,再下分成大翼手亞目與小翼手亞目;左圖為大翼手亞目的狐蝠,右圖為小翼手亞目的蹄鼻蝠。
圖一:蝙蝠在分類階層中屬於翼手目,再下分成大翼手亞目與小翼手亞目;左圖為大翼手亞目的狐蝠,右圖為小翼手亞目的蹄鼻蝠。
(作者提供)
地球上大多數的蝙蝠以昆蟲為食,可以利用迴聲定位尋找並且捕獲獵物;而少部分的蝙蝠則以小型哺乳動物、魚類、血液、水果或花粉作為食物。地球上除南極洲以外,大多數的地方都有蝙蝠的蹤跡,而蝙蝠也因為可以跨越物種壁壘,將病毒與傳染疾病感染給人類及其他的動物,像是有些蝙蝠已經被公認可以傳播狂犬病病毒,而伊波拉病毒(Ebolavirus)、SARS冠狀病毒(SARS-CoV)、MERS冠狀病毒(MERS-CoV)到最新爆發的新型冠狀病毒(SARS-CoV-2),也多被認為可能起源於蝙蝠。
不只是帶來災難—蝙蝠對人類的好
僅管被認為是人畜共通病毒的重要自然宿主,但牠們卻也是陸地生態系重要的一環,不但可以幫助人類控制害蟲的數目,提高農作物的產量;也可以透過捕食蚊蠅病媒,達到生物防治及減少化學殺蟲劑使用,降低人蟲間的疾病傳播。此外,蝙蝠可以幫助植物授粉,讓地球上許多植物得以繁衍後代,也為人類提供充足的蔬果等食物。有些地方,人類會利用蝙蝠的糞便作為有機肥料,或利用蝙蝠的唾液、血液,提取抗凝血藥物或特殊抗體。
近代科學家利用蝙蝠迴聲定位特性發展出潛艇的聲納系統、汽車的倒車雷達或醫院的超音波檢驗儀器。有些地方的人們為了防止蝙蝠傳播病毒與疾病,努力消滅野外蝙蝠的族群,結果造成昆蟲數目的上升,使農作物產量受到嚴重的損害,讓蚊蠅病媒傳播的瘧疾與登革熱的病例也日益嚴重,至於蝙蝠傳播的狂犬病等病例,卻也未見減少。
為什麼蝙蝠是病毒的好宿主?
血清學證據顯示蝙蝠身上感染許多病毒,但為什麼蝙蝠感染某些病毒後,可以健康無任何病徵的存活下來,但人類或其他的脊椎動物卻無法呢?由於蝙蝠是最早發展的哺乳動物之一,因此牠們的免疫系統與人類和其他脊椎動物存在顯著的差異性。蝙蝠為了適應飛行的生存方式,代謝率通常較同體型哺乳動物高,也讓蝙蝠容易產生遺傳物質的損傷。因此,蝙蝠在演化過程中可能會發展出較強的DNA損傷修復能力,讓蝙蝠的免疫系統變得十分神奇幾乎不會罹患癌症。另外,蝙蝠細胞的耐熱性高,在40℃的體溫下仍然保持相當穩定狀態,這也可能是抑制體內病毒複製的原因之一。更重要的一點,在蝙蝠體內的RNA病毒擁有非常高的遺傳多樣性,並且具有很高的突變重組性。因此,當RNA病毒突變重組成為新型病毒後,蝙蝠可以忍受這些新型病毒存在體內,但人類和其他哺乳動物卻會被新型病毒感染,造成人畜共通的疾病感染與疫情傳播。
生物特性造就蝙蝠的高傳染力
有些哺乳動物具有與蝙蝠相似的生理特徵,例如冬眠,但卻沒有像蝙蝠獨特的群聚繁殖及飛行遷徙特性。與其他哺乳動物比較,雖然蝙蝠出現的年代比較悠久,但是身體結構變化卻不大。由於蝙蝠對於地球環境變遷的高耐受性及強大的適應能力,使得依附在牠們身上病毒也一起存活下來。而病毒複製時需要用的細胞受體和生化途徑,可能因為受到環境中化學藥品及輻射物質的影響,增強這些病毒向其他哺乳動物的傳播能力。
此外,蝙蝠的飛行能力在哺乳動物中也是獨一無二的,每天利用飛翔來捕食昆蟲及躲避環境中的障礙物。有許多種蝙蝠在季節性遷徙期間會進行長距離飛行,例如墨西哥游離尾蝠(Tadarida brasiliensis)每年至少要飛行800英里來回遷移夏季洞穴與過冬洞穴之間。有些研究指出蝙蝠長距離的遷徙,可能會助長身上的病毒傳播與疾病傳染。此外,來自不同地區的同種蝙蝠,可能會遷徙到相同的洞穴進行繁殖或過冬,導致不同地區蝙蝠身上所攜帶的不同病毒得以相互雜交,進而產生新型的病毒或病毒變體。
而蝙蝠冬眠或休眠的生理習性,也是一項讓病毒長期存在的關鍵。研究指出,日本腦炎(Japanese encephalitis)病毒可以在冬眠蝙蝠的身上可以存活長達108 天,而狂犬病毒則可以藏在冬眠蝙蝠的棕色脂肪中存活整個冬季。另外,有些病毒可以透過垂直感染方式,由母蝠身上通過胎盤傳播給蝙蝠胎兒。
相較於同體型的哺乳動物,蝙蝠壽命很長,通常多數蝙蝠的壽命可以超過25年,最長壽命甚至可以長達35年,而同體型的嚙齒動物大約只有2~3年的壽命。如果蝙蝠經常被某些病毒感染,病毒傳染力可以持續數月甚至數年,加上蝙蝠經常群居的棲息行為,也大大增加病毒在種內和種間傳播的可能性。另外,也因為蝙蝠族群與空間的結構變化很大,進而提供病毒造成蝙蝠個體間感染的機會。而食蟲蝙蝠飛行時通過嘴巴或鼻孔發出超聲波時,也可能使得體內的病毒透過上呼吸道黏液或口腔唾液發散在空氣之中,使得病毒在環境中得以互相傳播並且有機會感染其他物種的生物。
蝙蝠身上的病毒種類
目前已知蝙蝠種類超過1000多種,雖然過去陸續從不同種類蝙蝠身上分離或檢測出近千種的病毒,其中只有少部分如狂犬病病毒(Rabies virus)、亨德拉病毒(Hendra virus)、尼帕病毒(Nipah virus)、梅南高病毒(Menangle virus)、伊波拉病毒、SARS冠狀病毒、MERS冠狀病毒及最新爆發的新型冠狀病毒被認為可能起源於蝙蝠,並且可以引起人類和其他脊椎動物疾病。事實上大多數蝙蝠身上攜帶的病毒,目前證據並未顯示可以引起人類和其他脊椎動物的疾病。全世界每年狂犬病病毒造成人類死亡約有55000例,但是只有一小部分是因為蝙蝠相關的病毒變異引起。在北美洲,現存蝙蝠相關狂犬病病毒主要發生在1651~1660年間;拉丁美洲發現的蝙蝠狂犬病病毒主要存在於吸血蝙蝠和游離尾蝠身上;歐亞大陸的蝙蝠也發現超過10種狂犬病病毒;大洋洲的澳大利亞蝙蝠身上發現的狂犬病病毒(Australian bat lyssavirus, ABLV),則已經被證實可以感染人類並且造成死亡。
蝙蝠病毒與人類的交手
1994年,澳大利亞的亨德拉鎮爆發了人類和馬的急性呼吸道疾病,而引發疾病的亨德拉病毒就是以狐蝠作為主要的自然宿主。無獨有偶,1997年在澳大利亞新南威爾斯(New South Wales)的養豬場也爆發了一場人豬共通的感染疾病,造成大量仔豬的死亡,並且讓母豬產下具有畸形缺陷的仔豬或死胎,受感染的人類則表現出發熱和麻疹等病癥。事後,科學家從病豬的肺、腦和心臟組織分離出一種新型病毒,並且命名為梅南高病毒。由於此一人豬共通感染疾病發生時,在養豬場附近棲息一群狐蝠,所以蝙蝠被懷疑與此事件有關。科學家進一步從養豬場附近採集到狐蝠的血清,發現該病毒的抗體,由於豬場附近其他野生動物和家畜的血清均無該病毒的抗體反應,因而認為狐蝠是梅南高病毒的自然宿主。
1999年,在馬來西亞半島和新加坡地區,發現許多成年男子因為不明的發燒和腦炎症狀陸續死亡,當時發現這些患者多為與活豬密切接觸的養豬戶。為此,當地政府撲殺超過100萬頭豬以控制疫情,事後研究發現此一疾病是由尼帕病毒所引起,而傳播尼帕病毒的自然宿主正是馬來西亞半島上的大型狐蝠。此外,在研究尼帕病毒自然宿主的過程中,有一種新病毒——刁曼病毒(Tioman virus)也意外地在狐蝠的尿液中被分離出來,儘管它與梅南高病毒很接近,但刁曼病毒是否引起人類和其他動物的疾病還未知。2001年迄今,尼帕病毒引發人類相關疾病的案例已陸續出現在孟加拉、印度、印尼和柬埔寨等國家,也有研究證據顯示尼帕病毒可以在人與人之間互相傳播。
2013年西非爆發嚴重的出血熱疫情,罹患此病有致死的可能,致死原因主要為中風、心肌梗塞、休克及器官衰竭。當時認為出血熱疫情,很可能是當地居民食用蝙蝠而導致感染。近一步研究指出,這種出血熱症狀是一種人畜共通的伊波拉病毒所引起,此病毒是以非洲剛果民主共和國的伊波拉河命名,主要的感染途徑是透過患者體液傳染,如血液、汗、嘔吐物、排泄物、尿液、唾液或精液等,伊波拉病毒的潛伏期最多可達21天,目前認為狐蝠是此病毒最可能的原始自然宿主。
而又是什麼因素促使這些病毒,可以在狐蝠與人類及其他動物之間互相傳播疾病?這可能是由於狩獵造成狐蝠棲息地的喪失。近年來,越來越多的狐蝠棲息地被人類破壞,導致狐蝠族群在生存壓力下,與人類和牲畜更加接近,終於導致病毒的擴張與疾病傳播。
蝙蝠是冠狀病毒疾病的元兇?
2002年,中國廣東市境內發生嚴重的急性呼吸道症候群(severe acute respiratory syndrome, SARS),研究指出該病是由一種從未見過的新型冠狀病毒所引起,後來被命名為SARS-CoV,傳播途徑包括由被感染者所咳出的飛沫傳染,傳染過程主要透過人與人近距離的接觸。2003年,香港大學的研究團隊認為果子狸為SARS冠狀病毒的自然宿主,但2006年的研究發現蝙蝠身上同樣攜帶SARS冠狀病毒。2013年的研究則指出中華菊頭蝠(Rhinolophus sinicus)應為SARS冠狀病毒的原始自然宿主,而果子狸則是傳染到人類過程中的中間宿主。
2012年,中東地區爆發中東呼吸症候群(MERS),患者常見的症狀為發燒、咳嗽、喉嚨痛或胸痛等症狀,且MERS的死亡率比SARS更高,惟傳染性較SARS低。經過實驗室分析,確認MERS也是由一種新型的冠狀病毒所引起,該病毒被命名為MERS-CoV,主要感染人類支氣管的無纖毛上皮細胞。它能避開宿主體內的免疫系統攻擊,並且阻止免疫細胞分泌干擾素。由於大部分冠狀病毒的自然宿主為蝙蝠,且有報告於中東地區蝙蝠樣本分離出MERS冠狀病毒,因此初步認為蝙蝠可能為MERS-CoV感染源,但仍有待進一步的證據證實。
去(2019)年,中國湖北省武漢市爆發多起病毒性肺炎群聚感染,國際病毒分類委員會(International Committee on Taxonomy of Viruses, ICTV)將造成肺炎疫情的新型冠狀病毒命名為SARS-CoV-2。由於此病毒對人類具有相當高度的染病性與致死率,因此臺灣將此疾病公告為第五類法定傳染病。此新型冠狀病毒感染臨床表現常見發燒、乾咳、肌肉痠痛或四肢乏力等,有些患者則出現咳嗽有痰、頭痛、咳血或腹瀉等症狀。當發展為重症患者,除雙肺呈現瀰漫性毛玻璃狀病變外,也會出現急性呼吸道窘迫症候群、敗血性休克,更嚴重的甚至導致死亡。研究指出新型冠狀病毒和來自貴州的中菊頭蝠(Rhinolophus affinis)〔註一〕體內的冠狀病毒的相似度高達 88%,與SARS冠狀病毒的相似度約79%,與MERS 冠狀病毒的相似度約53%,因此推測蝙蝠極有可能是新型冠狀肺炎病毒的原始自然宿主。但實際的感染源與中間宿主為何?則仍有待進一步確認。
在臺灣的蝙蝠病毒研究
在臺灣,行政院農委會家畜衛生試驗所自2008年開始建立野生動物監測系統,針對蝙蝠進行狂犬病病毒監測。由於蝙蝠可作為多數麗沙病毒(Lyssavirus,包含狂犬病病毒)的自然宿主,因此選擇蝙蝠作為主要監測物種。2016年,從東亞家蝠(Pipistrellus abramus)體內檢出新型麗沙病毒,研究團隊將該病毒命名為「臺灣蝙蝠麗沙病毒(Taiwan Bat Lyssavirus, TBLV)」。
另外,2016年中原大學教授陳怡寧的研究團隊指出:將20種臺灣蝙蝠的糞便樣品進行檢測,發現其中有8種蝙蝠的糞便樣品可檢出冠狀病毒,其中檢出率最高為高頭蝠(Scotophilus kuhlii),其次為臺灣小蹄鼻蝠(Rhinolophus monoceros)。研究也表示在臺灣,多種蝙蝠應該可以作為冠狀病毒的自然宿主,並且透過蝙蝠遷徙互相傳播(圖二)。
 圖二:在臺灣高頭蝠與小蹄鼻蝠為冠狀病毒主要宿主。(作者提供)
圖二:在臺灣高頭蝠與小蹄鼻蝠為冠狀病毒主要宿主。(作者提供)
另外,筆者在2019年與日本名古屋大學教授本道榮一合作研究,透過次世代定序(Next Generation Sequencing, NGS)技術分析臺灣及臨近國家東亞摺翅蝠(Miniopterus fuliginosus)採樣糞便內含的病毒基因組,分析結果發現蝙蝠糞便中主要含有腦心肌炎病毒(Encephalomyocarditis virus, EMCV)、腸道病毒F株(Enterovirus F)、兔病毒(Rabbit Haemorrhagic Disease Virus, RHDV)和西班牙綿羊腦炎病毒(spanish sheep encephalomyelitis virus, SSEV)等病毒的核酸,並發表在《國際病毒研究》(Virus Research)期刊中(圖三)。這些病毒是否會引發蝙蝠的繁殖障礙或個體死亡,更是未來研究的課題,此外,這些病毒是否會使得家畜感染疾病進而造成畜牧業的損害,也是臺灣農牧業值得關注的問題。
 圖三:在臺灣,腦心肌炎病毒可能源自東亞摺翅蝠。(作者提供)
圖三:在臺灣,腦心肌炎病毒可能源自東亞摺翅蝠。(作者提供)
病毒透過蝙蝠傳播至人類的可能途徑
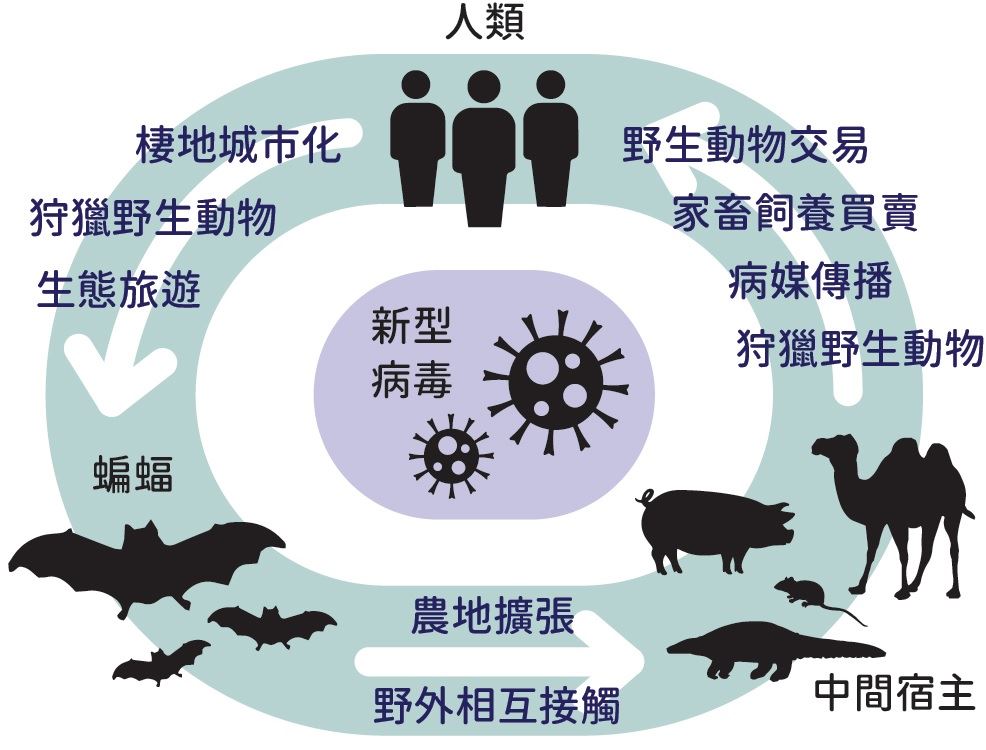
盼能揭開蝙蝠神秘面紗
近幾十年來,地球上出現了數十種新型的病毒,高度的人畜共通傳染及致死率,確實讓人們感覺到驚訝而且窮於應付。由於目前蝙蝠體內大多數病毒的研究還是有限,例如蝙蝠的病毒究竟是寄生還是共生?如何對人類和其他動物產生致病性?這些新型病毒是否也會透過節肢動物或其他潛在媒介自然傳播?吃水果的果實蝙蝠是否會向植物傳播病毒?而食蟲蝙蝠是否會是昆蟲和脊椎動物(或植物)的中間宿主?種種問題,都需要進一步的研究與解密。儘管如此,科學家仍堅信,新型病毒對於蝙蝠宿主的致命感染肯定不會符合該病毒的長期最佳利益,透過探索蝙蝠對於新型病毒的免疫機制及耐受性,應該有助於找出人類與新型病毒戰爭的解決之道。
〔註一〕Rhinolophus 在臺灣稱為「蹄鼻蝠屬」。
延伸閱讀
1. Zhou, P. et al., A pneumonia outbreak associated with a new coronavirus of probable bat origin, Nature, 2020.
2. Chen Y.N. et al., Detection of the Severe Acute Respiratory Syndrome-Related Coronavirus and Alphacoronavirus in the Bat Population of Taiwan, Zoonoses Public Health, Vol. 63(8): 608-615, 2016.